
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 |
分析 A、醋酸是弱电解质,不能完全电离,根据物料守恒来分析;
B、Na2S溶液中,所有的氢离子和氢氧根均来自于水的电离,根据质子守恒来分析;
C、FeCl3是强酸弱碱盐,在溶液中会水解显酸性;
D、Al2(SO4)3是强酸弱碱盐,在溶液中水解出硫酸和氢氧化铝.
解答 解:A、醋酸是弱电解质,只能部分电离为CH3COO-,还有未电离的CH3COOH,根据物料守恒可知有:c(CH3COO-)+c(CH3COOH)=0.1mol/L,故A正确;
B、Na2S溶液中,所有的氢离子和氢氧根均来自于水的电离,而水电离出的氢离子和氢氧根的浓度相同,故有:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B正确;
C、FeCl3是强酸弱碱盐,在溶液中会水解显酸性,故加酸能抑制其水解,而为了不引入杂质,要加盐酸,故C正确;
D、Al2(SO4)3(aq)中也存在水解平衡:Al2(SO4)3+6H2O?2Al(OH)3+3H2SO4;△H>0,加热蒸发时,平衡也向右移动水解反应吸热,但H2SO4难挥发.随着水分的蒸发,溶液中H2SO4浓度的增大,上列平衡又会向左移动,最终溶液蒸干,得到Al2(SO4)3固体,故D错误;
故选D.
点评 本题考查了溶液中的物料守恒、质子守恒以及盐类水解的应用难度不大,注意基础的掌握和知识点的理解.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 若两者中有一种为强电解质,则一定是BOH | |
| B. | 若HA是强酸,混合液中离子浓度关系一定是C(A-)>C(B+)>C(HO-)>C(H+) | |
| C. | 若混合液中存在离子水解,则一定是A-水解 | |
| D. | 两者混合后,BOH有可能过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | Zn+2HCl═ZnCl2+H2↑ | D. | 4Al+3O2+6H2O═4Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |  |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量氢氧化钠固体,溶液中c(OH-)减小 | |
| C. | 通入少量HCl气体,平衡向正反应方向移动 | |
| D. | 加入少量NH4Cl固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
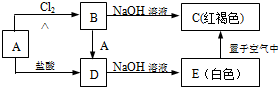
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com