
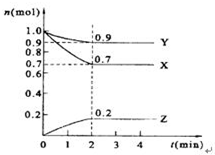
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.分析 (1)根据转化率=$\frac{转化量}{起始量}$×100%计算;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据v=$\frac{△c}{△t}$计算反应速率;
(4)根据平衡时各组分的物质的量不变正逆反应速率相同这一特征作判断.
解答 解:(1)X的转化率=$\frac{转化量}{起始量}$×100%=$\frac{(1mol-0.7mol)}{1mol}$×100%=30%,故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)v(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(4)根据图象可知,当在2mim时,反应中各组份的物质的量不再随时间变化而变化,此时反应达到平衡状态,3X+Y?2Z,反应前后气体体积减小,
A.消耗3molX的同时,消耗1molY,反应正向减小,不能说明反应达到平衡状态,故A错误;
B.X、Y、Z三种物质的浓度不再发生变化,是平衡标志,故B正确;
C.生成1molY的同时,生成2molZ,能说明反应正逆反应速率相同,反应达到平衡状态,故C正确;
D.X的物质的量不再发生变化说明反应达到平衡状态,故D正确;
故答案为:BCD.
点评 本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法及基本公式的应用.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(×10-10m) | 0.37 | 0.75 | 0.74 | 1.86 | 1.43 | 0.99 | |
| 主要化合价 | 最高正价 | +1 | +5 | +1 | +3 | +7 | |
| 最低负价 | -1 | -3 | -2 | -1 | |||
| A. | Z的氢化物的稳定性都大于Y的氢化物 | |
| B. | 化合物XQ、MQ都是电解质,熔融状态下都能电解 | |
| C. | 元素M、Q、Z的简单离子半径:r(M+)>r(Q-)>r(Z2-) | |
| D. | 在一定条件下,R可以溶于M、Y两种元素的最高价氧化物的水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中前三周期为短周期 | |
| B. | 第IA族的元素不全是金属元素 | |
| C. | 元素性质呈现周期性变化的根本原因是元素的相对原子质量呈周期性变化 | |
| D. | 人类可以在周期表中金属与非金属的分界线处,寻找半导材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
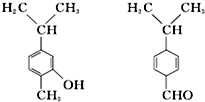
| A. | 是同分异构体 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 前者能与溴水反应后者不能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>b>d | C. | a>c>d>b | D. | b>d>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol 羟基(-OH)中电子数为9NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子数均为0.2NA | |
| C. | 将10.6 g Na2CO3固体溶于水,所得离子总数为0.3NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
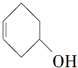 的叙述不正确的是( )
的叙述不正确的是( )| A. | 与HBr、溴水发生加成反应,产物都只有一种 | |
| B. | 分子式为C6H10O | |
| C. | 可发生加成、酯化和氧化反应 | |
| D. | 分子中有两种官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com