
| A. | H2SO4(稀) | B. | CuSO4 | C. | FeCl3 | D. | FeCl2 |
分析 根据物质间的反应进行分析,金属与酸反应金属溶于酸而使溶液质量增加,金属与盐溶液反应溶液质量的变化取决于参加反应的金属的质量和反应后置换出的金属的质量,若参加反应的金属的质量大于生成的金属的质量,则溶液质量增加,
A.稀硫酸和铁反应生成氢气,溶液中铁元素进入;
B.铁置换铜反应前后质量增加;
C.铁和氯化铁溶液反应生成氯化亚铁;
D.铁和氯化亚铁不反应.
解答 解:A、铁与硫酸反应,铁溶于硫酸而使溶液质量增加,铁片质量减少,故A正确;
B、铁与硫酸铜反应生产硫酸亚铁和铜,
Fe+CuSO4═FeSO4+Cu
56 64
参加反应的铁的质量小于生成的铜的质量,所以铁片质量增加,故B错误;
C.铁和氯化铁溶液反应生成氯化亚铁,Fe+2FeCl3=3FeCl2,溶液质量增大,故C正确;
D、铁与硫酸亚铁不反应,铁片质量不变,故D错误;
故选AC.
点评 本题考查金属铁的化学性质,探究与铁反应后金属质量增减的问题,可以依据物质间反应的化学方程式进行计算,根据与铁反应前后溶质的相对分子质量的大小来确定溶液质量的增减,并分析金属质量的增减,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ②③④ | C. | ②③④⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
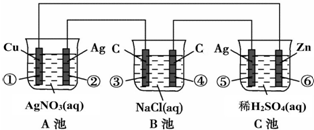
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
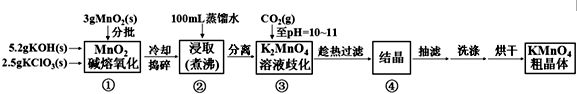
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

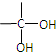 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
 .
.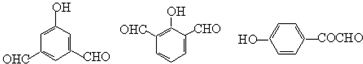 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | NO3-、K+、Cl-、Na+ | D. | K+、Cl-、Al3+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com