
【题目】(14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:
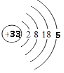
(1)画出砷的原子结构示意图 .
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)298K时,将20mL 3x molL﹣1 Na3AsO3、20mL 3x molL﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.
①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y molL﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡时溶液的pH=14,则该反应的平衡常数K为 .
【答案】
(1)
(2)2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率
(3)2△H1﹣3△H2﹣△H3
(4)ac;大于;小于;tm时AsO43﹣浓度更小,反应速率更慢;![]()
【解析】解:(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,原子结构示意图为 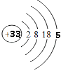 ,
,
所以答案是: 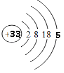 ;(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,
;(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,
所以答案是:2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率;(3)已知:①As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
②H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
③2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则利用盖斯定律将①×2﹣②×3﹣③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=2△H1﹣3△H2﹣△H3 ,
所以答案是:2△H1﹣3△H2﹣△H3;(4)①a.溶液pH不变时,则c(OH﹣)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I﹣)=2v(AsO33﹣),故b错误;
c.c (AsO43﹣)/c (AsO33﹣)不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c (AsO43﹣)=y molL﹣1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I﹣)=2y molL﹣1 , 所以c(I﹣)=y molL﹣1时没有达到平衡状态,故d错误.
所以答案是:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正 大于 v逆 , 所以答案是:大于;
③tm时比tn时浓度更小,则逆反应速率更小,所以答案是:小于;tm时AsO43﹣浓度更小,反应速率更慢;
④反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L× ![]() =xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43﹣)为ymol/L,则反应生产的c(I﹣)=2ymol/L,消耗的AsO33﹣、I2的浓度均为ymol/L,平衡时c(AsO33﹣)=(x﹣y)mol/L,c(I2)=(x﹣y)mol/L,溶液中c(OH﹣)=1mol/L,则K=
=xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43﹣)为ymol/L,则反应生产的c(I﹣)=2ymol/L,消耗的AsO33﹣、I2的浓度均为ymol/L,平衡时c(AsO33﹣)=(x﹣y)mol/L,c(I2)=(x﹣y)mol/L,溶液中c(OH﹣)=1mol/L,则K= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】(18分)2﹣氨基﹣3﹣氯苯甲酸(F)是重要的医药中间体,其制备流程图如下: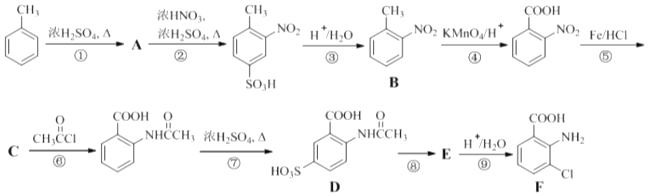
已知: 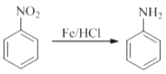
回答下列问题:
(1)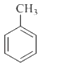 分子中不同化学环境的氢原子共有种,共面原子数目最多为 .
分子中不同化学环境的氢原子共有种,共面原子数目最多为 .
(2)B的名称为 . 写出符合下列条件B的所有同分异构体的结构简式 .
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,目的是 .
(4)写出⑥的化学反应方程式: , 该步反应的主要目的是 .
(5)写出⑧的反应试剂和条件:;F中含氧官能团的名称为 .
(6)在方框中写出以 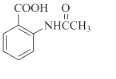 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途.某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化.再向试管中通入空气,溶液逐渐变红.由此可知:、 .
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验.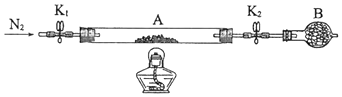
①仪器B的名称是 .
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g.
a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”).
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热.实验后反应管中残留固体为红色粉末.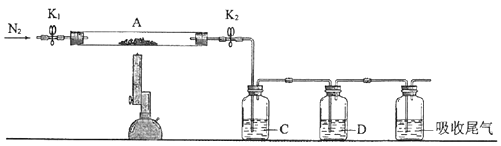
①C、D中的溶液依次为(填标号).C、D中有气泡冒出,并可观察到的现象分别为 .
a.品红b.NaOHc.BaCl2d.Ba(NO3)2e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有两种溶质NaCl和H2SO4 , 物质的量之比为3:1.用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
A.阴极只析出H2
B.阳极先析出Cl2 , 后析出O2
C.电解最后阶段为电解水
D.溶液pH不断增大,最后为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①②④B.②③C.①④⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐、食醋、纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
A. 鉴别AgNO3溶液和BaCl2溶液 B. 检验鸡蛋壳(CaCO3)能否溶于酸
C. 除去热水瓶内壁上的水垢 D. 检验自来水中是否含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合物Z由如下反应得到:C4H9Br ![]() Y
Y ![]() Z,Z的结构简式不可能是( )
Z,Z的结构简式不可能是( )
A.CH3CH(CH2Br)2
B.CH3CH2CHBrCH2Br
C.H3CHBrCHBrCH3
D.CH2BrCBr(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com