
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
分析 根据表格中氯化物的熔沸点判断物质的晶体类型,一般离子晶体的熔沸点大于分子晶体的熔沸点.
解答 解:①由表格中的数据可知AlCl3的熔沸点较低,则AlCl3属于分子晶体,加热时能升华,故①正确;
②由表格中的数据可知SiCl4的熔沸点较低,则SiCl4是分子晶体,故②正确;
③由表格中的数据可知,NaCl的沸点为1465℃,则属于离子晶体,粒子之间以离子键结合,故③错误;
④由表格中的数据可知AlCl3的熔沸点较低,则AlCl3属于分子晶体,故④错误;
故选A.
点评 本题考查晶体类型与晶体熔沸点的关系,明确表格中的数据及一般离子晶体的熔沸点大于分子晶体的熔沸点是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
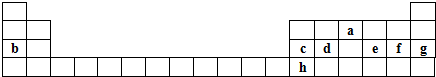
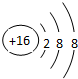 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓、稀硝酸都能使蓝色石蕊试纸最终变为红色 | |
| B. | 硝酸能与Cu反应,只表现氧化性 | |
| C. | 硝酸可与Na2S反应制得H2S气体 | |
| D. | 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和氯气按1:1混合,在光照下发生取代反应时,有机产物只有一种 | |
| B. | 在氧气中燃烧时只生成CO2和H2O的物质一定是烃 | |
| C. | 乙酸是有机弱酸,所以它的酸性比碳酸弱 | |
| D. | 在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 页岩气是一种清洁的能源 | |
| B. | 使用页岩气是对化学能的充分利用 | |
| C. | 使用页岩气给农民的生活带来了不便 | |
| D. | 页岩气是我州解决能源的重要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
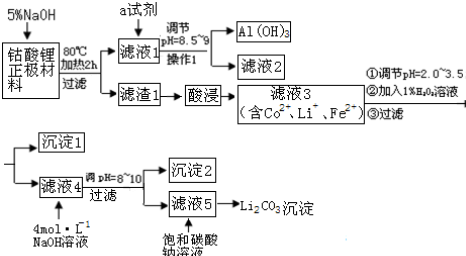
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 0.75 mol | C. | 0.5 mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
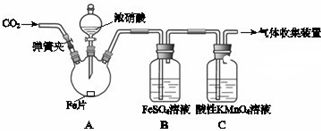
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com