
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7����K2=5.6��10-11 |
���� ��1�������������ˮ��̶�Խ��ͬ������ͬpHֵ��������ҺŨ��ԽС��
���������¶Ȳ��䣬��CH3COOH��Һ�м���һ����������CH3COOH�������ɵ�H+��NH3��Ӧ����NH4+���ٽ�CH3COOH���룬���ӻ�����������ƽ�ⳣ��ֻ���¶��йأ�
��2����ͬŨ�ȵ��⼸�����У���ĵ���ƽ�ⳣ��Խ���������Խǿ��HCN����ƽ�ⳣ��С��H2CO3��һ������ƽ�ⳣ�������ڵڶ�������ƽ�ⳣ������������NaCN��Һ��ͨ��������CO2�����߷�Ӧ����̼�����ƺ�HCN��
��3��̼������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ����һ������̶�ԶԶ���ڵڶ�������̶ȣ���ϵ���غ��ж���Һ������Ũ�ȴ�С˳����ͬŨ�ȵ�̼���ƺ�̼��������Һ�����������ˮ��̶�Խ����Һ�ļ���Խǿ��pHԽ��
��� �⣺��1�������������ˮ��̶�Խ��ͬ������ͬpHֵ��������ҺŨ��ԽС����ĵ���ƽ�ⳣ��Խ�����Ӧ���������ˮ��̶�ԽС�����ݱ�������֪���������ˮ��̶ȴ�С˳����CO32-��CN-��HCO3-��������������Ũ�ȴ�С˳����NaHCO3��NaCN��Na2CO3���ʴ�Ϊ��NaHCO3��NaCN��Na2CO3��
���������¶Ȳ��䣬��CH3COOH��Һ�м���һ����������CH3COOH�������ɵ�H+��NH3��Ӧ����NH4+���ٽ�CH3COOH���룬
a���ٽ�������룬����Һ��c��CH3COO-�����ʴ���
b������������ɵ������ӺͰ�����Ӧ����笠����ӣ�������Һ��c��H+����С������ȷ��
c��KWֻ���¶��йأ��¶Ȳ��䣬���ӻ��������䣬�ʴ���
d���������ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬�������ƽ�ⳣ�����䣬�ʴ���
��ѡb��
��2����ͬŨ�ȵ��⼸�����У���ĵ���ƽ�ⳣ��Խ���������Խǿ�����ݱ�������֪��������ǿ����HSCN����������HCO3-��HCN����ƽ�ⳣ��С��H2CO3��һ������ƽ�ⳣ�������ڵڶ�������ƽ�ⳣ������������NaCN��Һ��ͨ��������CO2�����߷�Ӧ����̼�����ƺ�HCN�����ӷ���ʽΪCN-+H2O+CO2=HCN+HCO3-��
�ʴ�Ϊ��HSCN��HCO3-��CN-+H2O+CO2=HCN+HCO3-��
��3��Na2CO3Ϊǿ�������Σ�ˮ��ʼ��ԣ�����Һ�д���CO32-+H2O?HCO3-+OH-��HCO3-+H2O?H2CO3+OH-����CO32-ˮ��ˮ���Լ��ԣ��ҵ�һ��ˮ����ڵ�һ�����룬������Ũ�ȹ�ϵΪ��c��Na+����c��CO32-����c��OH-����c ��HCO3-����c��H+����
��ͬŨ�ȵ�̼���ƺ�̼��������Һ�����������ˮ��̶�Խ����Һ�ļ���Խǿ��pHԽ��ˮ��̶�CO32-��HCO3-��������ͬŨ�ȵ�Na2CO3��NaHCO3��Һ�У�pH�ϴ����Na2CO3��
�ʴ�Ϊ��c��Na+����c��CO32-����c��OH-����c ��HCO3-����c��H+����Na2CO3��
���� ���⿼��������ʵĵ��뼰����ˮ�⣬Ϊ��Ƶ���㣬���ؿ���ѧ���������ж���������ȷ������ʵ���ƽ�ⳣ���������Ӧ��������ˮ��̶ȹ�ϵ�ǽⱾ��ؼ���ע��̼�ἰ̼�������������Ӧ��������ӣ�Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 +3HNO3 $��_{��}^{Ũ����}$
+3HNO3 $��_{��}^{Ũ����}$ +3H2O��
+3H2O�� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
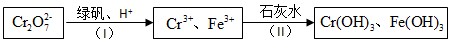
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� ���� | I A | ��A | ��A | ��A | ��A | ��A | ��A | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Q1��Q3��Q2 | B�� | Q1��Q2��Q3 | C�� | Q2��Q1��Q3 | D�� | Q3��Q1��Q2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com