
分析 反应8NH3+3Cl2═6NH4Cl+N2,N元素的化合价升高,Cl元素的化合价降低,该反应中转移6e-,以此来解答.
解答 解:(1)反应中N元素化合价升高,作为还原剂被氧化,N2为氧化产物,Cl元素化合价降低,Cl2为氧化剂被还原,故答案为:Cl;NH3;
(2)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为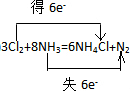 ,故答案为:
,故答案为: ;
;
(3)由方程式可知,当有3molCl2参加反应时,有2molNH3被氧化,而33.6LCl2的物质的量为1.5mol,所以被氧化的NH3的物质的量为$\frac{1.5}{3}×2$mol=1mol,
故答案为:1;
(4)由题意可知反应为:3Cl2+5NH3=N2+3NH4Cl+3HCl,所以参加反应的Cl2和NH3的物质的量之比为3:5,故答案为:3:5.
点评 本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
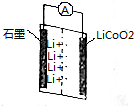 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )| A. | 石墨为正极 | |
| B. | 充电时,阳极质量不变 | |
| C. | 充电时,阴极反应式为xLi-xe-═xLi+ | |
| D. | 放电时,正极反应为xLi+Li1-xCoO2+xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
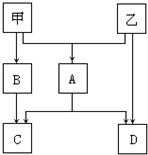 甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫 | B. | 氮的氧化物 | C. | 二氧化碳 | D. | 臭氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
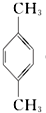 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5 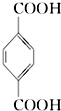 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过加聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 12N A 个电子 ( NA 为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
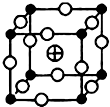 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途. 、
、 、
、 分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.
分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
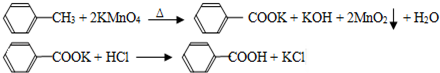
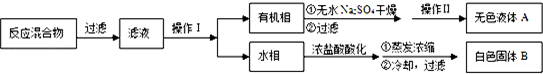
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解,冷却、过滤 | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com