
| A. | 现象相同,沉淀量相等 | B. | 现象不同,沉淀量不等 | ||
| C. | 现象相同,沉淀量不等 | D. | 现象不同,沉淀量相等 |
分析 NaOH溶液分多次加到AlCl3溶液中,发生Al3++3OH-═Al(OH)3↓,将AlCl3溶液分多次加到NaOH溶液中,分别发生Al3++4OH-=AlO2-+2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓,以此进行判断.
解答 解:100mL 3mol•L-1NaOH溶液中n(NaOH)=0.3mol,100mL 1mol•L-1的AlCl3溶液中n(AlCl3)=0.1mol,则
①将NaOH溶液分多次加到AlCl3溶液中,发生:Al3++3OH-═Al(OH)3↓,现象为观察到白色沉淀;
②将AlCl3溶液分多次加到NaOH溶液中,分别发生:Al3++4OH-=AlO2-+2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓,先没有沉淀后出现沉淀,
所以二者现象不同,由于AlCl3最后全部转化为Al(OH)3,沉淀质量相等.
故选D.
点评 本题考查钠的化合物的性质,为高频考点,侧重学生的分析能力的考查,题目难度不大,学习中注意相关基础知识的积累,特别是铝三角知识,为中学元素化合物中的重要内容.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26.3 | B. | 13.2 | C. | 19.8 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氢气所含原子数目为NA (提示:M(H2)=2g/mol) | |
| D. | 常温常压下,11.2L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4 mol硫被氧化 | |
| D. | 每转移1.2 mol电子,有0.3 mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离乙酸和乙酸乙酯,常用蒸馏法 | |
| B. | 提纯含有碘的氯化铵,常用升华法 | |
| C. | 除去碳酸钠中的少量碳酸氢钠,常用加热法 | |
| D. | 除去CO2中的SO2,通过盛有溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
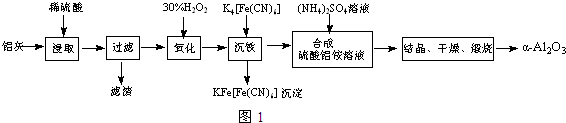
 (2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.
(2)加30%的H2O2溶液的目的是氧化Fe2+为Fe3+,有利于在沉铁过程中除去.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
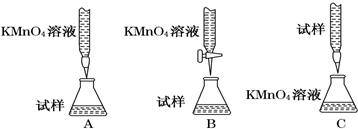
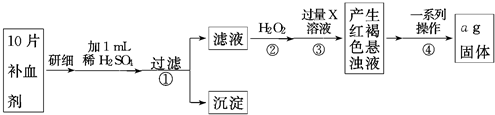
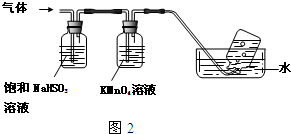
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com