
| A. | 无色透明的溶液:Na+、Al3+、Cl-、OH- | |
| B. | pH=1的溶液:Na+、NH4+、Cu2+、NO3- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
分析 A.无色透明的溶液中不存在有色离子,铝离子与氢氧根离子反应;
B.pH=1的溶液为酸性溶液,Na+、NH4+、Cu2+、NO3-之间不发生反应,都不与氢离子反应;
C.与铝反应产生大量氢气的溶液为酸性或者碱性溶液,铝离子能够与氢氧根离子反应;
D.使紫色石蕊试液变红的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.Al3+、OH-之间能够发生反应,在溶液中不能大量共存,故A错误;
B.pH=1的溶液中存在大量氢离子,Na+、NH4+、Cu2+、NO3-之间不反应,也不与氢离子反应,在溶液中能够大量共存,故B正确;
C.与铝反应产生大量氢气的溶液中存在大量的氢离子或者氢氧根离子,Al3+能够与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.使紫色石蕊试液变红的溶液中存在大量氢离子,NO3-离子在酸性溶液中具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②③④ | C. | ①②③⑤ | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线: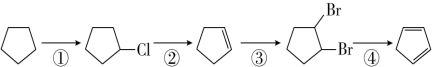
 ),途径如下:
),途径如下: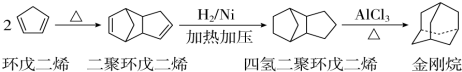
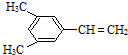 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
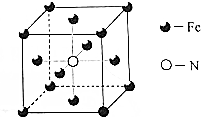 NH3可用来制尿素(
NH3可用来制尿素(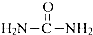 )等化学肥料.
)等化学肥料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均为水作还原剂的氧化还原反应 | |
| C. | Cl元素的单质在化学反应中只表现氧化性 | |
| D. | NaSO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com