
【题目】碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的食盐都是“加碘食盐”.“加碘食盐”中加的是含碘元素的物质是碘酸钾(KIO3),KIO3属于( )
A.酸
B.碱
C.盐
D.氧化物
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A.氯化钡、四氯化碳、硫酸、碘酒都属于化合物
B.硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物
C.溶液、浊液、胶体、空气都属于混合物
D.CO2、SO2、P2O5、CO都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在化工生产过程中有重要意义。下面是以烯烃A为原料合成粘合剂M的路线图。

回答下列问题:
(1)下列关于路线图中的有机物或转化关系的说法正确的是_______(填字母)。
A.A能发生加成、氧化、缩聚等反应
B.B的结构简式为CH2ClCHClCH3
C.C的分子式为C4H5O3
D.M的单体是CH2=CHCOOCH3和CH2=CHCONH2
(2)A中所含官能团的名称是_______,反应①的反应类型为_________。
(3)设计步骤③⑤的目的是_________, C的名称为________。
(4)C和D生成粘合剂M的化学方程式为____________。
(5)满足下列条件的C的同分异构体共有__种(不含立体异构),写出其中核磁共振氢谱有3组峰的同分异构体的结构简式:_____________。
①能发生银镜反应 ② 酸、碱性条件下都能水解 ③ 不含环状结构
(6)结合信息,以CH3CH=CHCH2OH为原料(无机试剂任选),设计制备CH3CH=CHCOOH的合成路线。合成路线流程图示例如下:_____________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在一定条件下既可以氧化成羧酸,又可以还原成醇,该酸和该醇可生成分子式为C4H8O2的酯,则下列说法错误的是( )
A.该有机物既有氧化性又有还原性
B.该有机物能发生银镜反应
C.将该有机物和分子式C4H8O2的酯组成混合物,只要总质量一定不论怎样调整二者的物质的量之比,完全燃烧时得到二氧化碳的量必定相等
D.该有机物是乙酸的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。

(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:

①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景。在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为 2H2(g)+CO(g)![]() CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。
CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图所示。

回答下列问题:
(1)代表H2浓度变化的曲线为_______(填“a”、“b”或“c”)。
(2)提出一条可以加快反应速率的措施:______________________________。
(3)04 min内,CH3OH的平均反应速率为_________________。
(4)我国某高校化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

①该电池工作时,c口通入的物质为_____________,该电极为____(填“正极”或“负极”)。
②该电池工作一段时间后,,当6.4 g甲醇完全反应生成CO2时,消耗的氧气的体积为_____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
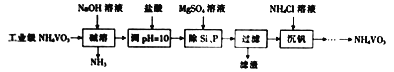
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
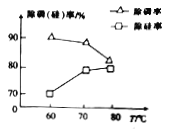
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com