
已知:2Na[Al(OH)4]+CO2—→2Al(OH)3↓+Na2CO3+H2O。向含2 mol NaOH、1 mol Ba(OH)2、2 mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
答案 B
解析 向含2 mol NaOH、1 mol Ba(OH)2、2 mol Na[Al(OH)4]的混合溶液中慢慢通入CO2发生反应依次为
2NaOH +CO2 —→ Na2CO3 +H2O
2 mol 1 mol 1 mol
Ba(OH)2 + CO2 —→ BaCO3↓+H2O
1 mol 1 mol 1 mol
2Na[Al(OH)4]+CO2—→2Al(OH)3↓+Na2CO3+H2O
2 mol 1 mol 2 mol 1 mol
Na2CO3+CO2+ H2O—→2NaHCO3
1 mol 1 mol
BaCO3+CO2+H2O—→Ba(HCO3)2
1 mol 1 mol
当通入2 mol CO2时,生成1 mol BaCO3沉淀;
当通入3 mol CO2时,生成1 mol BaCO3沉淀和2 mol Al(OH)3沉淀;
当通入4 mol CO2时,生成1 mol BaCO3沉淀和2 mol Al(OH)3沉淀;
当通入5 mol CO2时,生成2 mol Al(OH)3沉淀;当通入 6 mol CO2时,BaCO3已完全反应,Al(OH)3量不变,即仍为 2 mol 沉淀。


科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免________________________________________________________________________。
(2)Br2可用热空气吹出,其原因是________________________________________________________________________。
(3)写出步骤③所发生的化学反应方程式________________________________________________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为
________________________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中________________________________________________________________________。
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
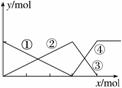
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO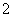 的物质的量的变化
的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
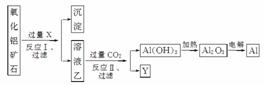
对上述流程中的判断正确的是( )
A.试剂X可以为氨水,沉淀中含有铁的化合物
B.CO2可以用H2SO4溶液或稀盐酸代替
C.反应Ⅱ中的反应为CO2+AlO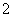 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO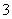
D.工业上还可采用Fe还原Al2O3的方法制Al,成本更低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.只有①③④⑤
C.只有③④⑤ D.只有②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入250 mL 2.0 mol·L-1的稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如图所示。则下列说法正确的是( )
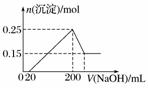
A.当加入氢氧化钠溶液的体积为20 mL时,溶液的pH等于7
B.当加入氢氧化钠溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝
C.NaOH溶液的物质的量浓度为5 mol·L-1
D.生成的H2在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
往甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中溶质的质量分数大小顺序是( )
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
海水的综合利用可以制备金属镁,其流程如下:

(1)海水提镁要用到海滩上的贝壳,它的作用是________________________________,贝壳经历的有关变化的化学方程式是____________________。
(2)写出由MgCl2得到金属镁的反应方程式________________________________________________________________________
________________________________________________________________________。
(3)Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?(写出实验步骤)________________________________________________________________________。
(4)从经济效益角度看,该化工厂的厂址应选择在________________________________________________________________________
________________________________________________________________________。
(5)实验室中将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下用到玻璃棒的目的。
溶解时:________________________________________________________________________;
过滤时:________________________________________________________________________;
蒸发时:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com