
| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
分析 A、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化;
B、使用催化剂加快了反应速率,缩短反应时间,提高反应效率;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等;
D、正反应是放热反应,升高温度平衡逆向移动.
解答 解:A、因该反应是可逆反应,存在反应限度,反应物不可能100%的转化,所以最终生成的SO3一定少于2 mol,故A正确;
B、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,平衡不移动,故B正确;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故C错误;
D、正反应是放热反应,升高温度平衡逆向移动,不利提高SO3的产率,故D错误;
故选CD.
点评 本题考查了影响化学平衡移动的因素,难度不大,注意影响化学反应速率和化学平衡的影响因素分析判断.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
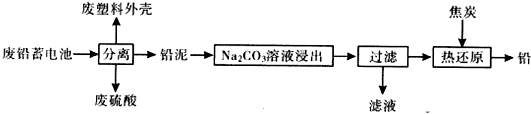
| 物质 | Ksp(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 | |
| B. | 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 | |
| C. | 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2在反应中被还原 | B. | Br2在反应中失去电子 | ||
| C. | Br2在反应中表现氧化性 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com