
| ŠņŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż | ¢Ž |
| ŅĒĘ÷¼°×°ÖĆĶ¼ | 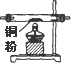 |  |  |  |  |  |
·ÖĪö £Ø1£©ŅĒĘ÷µÄĮ¬½Ó·½·Ø£ŗĻČÖʱø·“Ó¦Īļ£¬Č»ŗó³żŌÓÖŹ£¬ŌŁŹ¹ĀČĘųÓėĶ·“Ó¦£¬×īŗóĪ²Ęų“¦Ąķ£»½ųŠŠĘųĢå³żŌÓ»ņÕßøÉŌļŹ±£¬Į¬½ÓĖ³ŠņŅ»°ćŹĒ£ŗ”°³¤½ų¶Ģ³ö”±µÄŌŌņ£¬øł¾ŻĢāÖŠŹµŃéŌĄķ£¬ÓĆÅØŃĪĖįÓė¶žŃõ»ÆĆĢ·“Éś³ÉĀČĘų£¬³żŌÓŗóÓėĶ·“Ӧɜ³ÉĀČ»ÆĶ£¬Ī²ĘųÓĆĒāŃõ»ÆÄĘĪüŹÕ£¬¾Ż“Ė“šĢā£»
£Ø2£©×°ÖĆ¢ŽŹĒÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕĀČĘųĪ²Ęų£»
£Ø3£©ŹµŃéÖŠÉę¼°ĘųĢåµÄ£¬ŹµŃéæŖŹ¼Ź±Ņ»°ć¶¼ŅŖ¼ģŃé×°ÖĆĘųĆÜŠŌ£¬ĪŖĮĖ·ĄÖ¹æÕĘųÖŠµÄ³É·ÖµÄøÉČÅ£¬ŹµŃé½įŹųŹ±£¬ÓŠĶ·ŪµÄ×°ÖĆÖŠ»¹Ó¦ŌŁÄÜŅ»»į¶łĀČĘų£»
£Ø4£©ŌŚ×°ÖĆ¢ŻµÄÉÕĘæÖŠ·¢ÉśµÄ·“Ó¦ĪŖ¶žŃõ»ÆĆĢÓėÅØŃĪĖį¼ÓČČÉś³ÉĀČĘų£»
£Ø5£©ĀČ»ÆĶ¹ĢĢåĪŖ×Ų»ĘÉ«£¬ĀČ»ÆĶ±„ŗĶČÜŅŗ³ŹĀĢÉ«£Ø»ņĄ¶ĀĢÉ«£©£»
£Ø6£©øł¾Ż·½³ĢŹ½MnO2+4HCl£ØÅØ£©ØTMnCl2+Cl2+2H2O”«2e-£¬æɼĘĖć³ö±»Ńõ»ÆµÄHClµÄĪļÖŹµÄĮæ¼°×ŖŅʵē×ÓŹż£»
½ā“š ½ā£ŗ£Ø1£©ŅĒĘ÷µÄĮ¬½Ó·½·Ø£ŗĻČÖʱø·“Ó¦Īļ£¬Č»ŗó³żŌÓÖŹ£¬ŌŁŹ¹ĀČĘųÓėĶ·“Ó¦£¬×īŗóĪ²Ęų“¦Ąķ£»½ųŠŠĘųĢå³żŌÓ»ņÕßøÉŌļŹ±£¬Į¬½ÓĖ³ŠņŅ»°ćŹĒ£ŗ”°³¤½ų¶Ģ³ö”±µÄŌŌņ£¬øł¾ŻĢāÖŠŹµŃéŌĄķ£¬ÓĆÅØŃĪĖįÓė¶žŃõ»ÆĆĢ·“Éś³ÉĀČĘų£¬³żŌÓŗóÓėĶ·“Ӧɜ³ÉĀČ»ÆĶ£¬Ī²ĘųÓĆĒāŃõ»ÆÄĘĪüŹÕ£¬ĖłŅŌŅĒĘ÷Į¬½ÓĖ³ŠņĪŖ£ŗ¢Ū¢Ż¢Ü¢Ś¢Ł¢Ž£¬¢ŚÓė¢Ü×°ÖĆĻąĮ¬Ź±£¬²£Į§¹Ü½ÓæŚ£ØÓĆ×°ÖĆÖŠ×ÖÄø±ķŹ¾£©Ó¦ŹĒ½ÓC£¬
¹Ź“š°øĪŖ£ŗ¢Ū¢Ż¢Ü¢Ś¢Ł¢Ž£»C£»
£Ø2£©×°ÖĆ¢ŽŹĒÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕĀČĘųĪ²Ęų£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒCl2+2OH-=Cl-+ClO-+H2O£¬
¹Ź“š°øĪŖ£ŗCl2+2OH-=Cl-+ClO-+H2O£»
£Ø3£©ŹµŃéÖŠÉę¼°ĘųĢåµÄ£¬ŹµŃéæŖŹ¼Ź±Ņ»°ć¶¼ŅŖ¼ģŃé×°ÖĆĘųĆÜŠŌ£¬ĪŖĮĖ·ĄÖ¹æÕĘųÖŠµÄ³É·ÖµÄøÉČÅ£¬ŹµŃé½įŹųŹ±£¬ÓŠĶ·ŪµÄ×°ÖĆÖŠ»¹Ó¦ŌŁÄÜŅ»»į¶łĀČĘų£¬ĖłŅŌŹµŃé½įŹųŹ±£¬Ó¦ĻČĻØĆš¢Ł“¦µÄ¾Ę¾«µĘ£¬
¹Ź“š°øĪŖ£ŗĘųĆÜŠŌ£»¢Ł£»
£Ø4£©ŌŚ×°ÖĆ¢ŻµÄÉÕĘæÖŠ·¢ÉśµÄ·“Ó¦ĪŖ¶žŃõ»ÆĆĢÓėÅØŃĪĖį¼ÓČČÉś³ÉĀČĘų£¬·“Ó¦µÄ·½³ĢŹ½ĪŖMnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2+2H2O£¬
¹Ź“š°øĪŖ£ŗMnO2+4HCl£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2+2H2O£»
£Ø5£©ĀČ»ÆĶ¹ĢĢåĪŖ×Ų»ĘÉ«£¬ĀČ»ÆĶ±„ŗĶČÜŅŗ³ŹĀĢÉ«£Ø»ņĄ¶ĀĢÉ«£©£¬ĖłŅŌ×°ÖĆ¢ŁµÄ²£Į§¹ÜÖŠŹ£ÓąĪļ³Ź×Ų»ĘÉ«£¬ĄäČ“ŗ󣬽«ÖĘµĆµÄ²śĪļÅä³É±„ŗĶČÜŅŗ£¬ČÜŅŗ³ŹĀĢÉ«£Ø»ņĄ¶ĀĢÉ«£©£¬
¹Ź“š°øĪŖ£ŗ×Ų»Ę£»ĀĢ£Ø»ņĄ¶ĀĢ£©£»
£Ø6£©øł¾Ż·½³ĢŹ½MnO2+4HCl£ØÅØ£©ØTMnCl2+Cl2+2H2O”«2e-
4mol 1mol 2mol
æÉÖŖ²ĪÓė·“Ó¦µÄHClĪŖ4mol£¬ĘäÖŠ±»Ńõ»ÆµÄĪŖ2mol£¬×ŖŅʵē×ÓŹżĪŖ2NA£¬
¹Ź“š°øĪŖ£ŗ2mol£»2NA£®
µćĘĄ ±¾Ģāæ¼²éĮĖ³£¼ūĘųĢåµÄÖĘČ”ŗĶŹÕ¼Æ¼°ŹµŃéµÄ×¢ŅāŹĀĻī£¬ĀČ»ÆĢśµÄŠŌÖŹŗĶÖĘČ”£»¹Ų¼üŹĒÕĘĪÕĘäŃ”ŌńµÄŅĄ¾Ż¼°ŌĄķ£¬ŌŚ×°ÖƵķÖĪöÖŠĆ÷Č·×°ÖƵÄĢŲµć¼°Ęä×÷ÓĆ£¬ÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3£ŗ2 | B£® | 3£ŗ1 | C£® | 2£ŗ1 | D£® | 2£ŗ3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢåĻµµÄŃ¹Ēæ²»ŌŁ·¢Éś±ä»Æ | |
| B£® | VÕż£ØCO£©=VÄę£ØH2O£© | |
| C£® | ĢåĻµµÄĘųĢåµÄĆܶČŗĶĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ·¢Éś±ä»Æ | |
| D£® | 1 mol H-H¼ü¶ĻĮѵÄĶ¬Ź±Éś³É2 mol H-O¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£®| ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó | ½į ĀŪ |
| ĻņŅŃĶŹÉ«µÄČÜŅŗÖŠ¼ÓČėŹŹĮæNaOHČÜŅŗ | ČÜŅŗ±äŗģ | ¼ŁÉč¢Ł³ÉĮ¢ |
| ČÜŅŗ²»±äŗģ | ¼ŁÉč¢Ś³ÉĮ¢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ¼× | ŅŅ | ±ū | ||
| ĘšŹ¼ĪļÖŹµÄĮæ | n£ØA£©/mol | 0.4 | 0.8 | 0.8 |
| n£ØB£©/mol | 0.24 | 0.24 | 0.48 | |
| AµÄĘ½ŗā×Ŗ»ÆĀŹ | 80% | ¦Į1 | ¦Į2 | |
| A£® | ¼×“ÓæŖŹ¼µ½Ę½ŗāŹ±¦Ķ£ØA£©ĪŖ0.032mol•L-1•min-1 | |
| B£® | Ę½ŗāŹ±£¬AµÄ×Ŗ»ÆĀŹ£ŗ¦Į1£¼80%£¼¦Į2 | |
| C£® | T”ꏱ£¬Ę½ŗā³£ŹżK=400L/mol | |
| D£® | ¾ųČČČŻĘ÷ÖŠ£¬Ń¹ĖõĢå»ż£¬Ę½ŗā³£ŹżK£¾400 L/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ5 minÄŚøĆ·“Ó¦ÓĆC±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.02 mol•L-1•min-1 | |
| B£® | 5 minŹ±£¬ČŻĘ÷ÄŚDµÄÅضČĪŖ0.2 mol•L-1 | |
| C£® | µ±ČŻĘ÷ÄŚŃ¹Ēæ±£³Öŗć¶ØŹ±£¬øĆæÉÄę·“Ó¦“ļµ½Ę½ŗāדĢ¬ | |
| D£® | 5 minŹ±ČŻĘ÷ÄŚĘųĢå×ܵÄĪļÖŹµÄĮæĪŖ3 mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com