
运用化学反应原理研究卤族元素的性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写字母)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
写出84消毒液露置在空气中发生反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1 mol·L-1的一元酸HA等体积混合,所得溶液pH=7,则c1________0.1 mol·L-1(填“≥”、“=”或 “≤”),溶液中离子浓度的大小关系为______________________________。若将上述“0.1 mol·L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液pH仍为7,则c1________0.1 mol·L-1。
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石,研究证实氟磷灰石比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=____________,氟离子与之反应转化的离子方程式为
________________________________________________________________________。
.解析:(1)氯水中存在次氯酸的电离和水的电离两种平衡;向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱;当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气,酸性增强会抑制次氯酸的电离,故比值增大;加水稀释氯水,溶液中的OH-浓度增大;加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:c(Na+)=c(Cl-)+c(ClO-)。
答案:(1)aef
(2)ClO-+CO2+H2O===HClO+HCO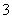
2HClO 2H++2Cl-+O2↑
2H++2Cl-+O2↑
(3)≤ c(Na+)=c(A-)>c(OH-)=c(H+) ≥
(4)c5(Ca2+)·c3(PO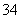 )·c(OH-)
)·c(OH-)
Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
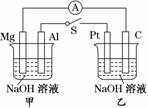
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH不变
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是( )
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(a)<M(c) M(b)>M(d)
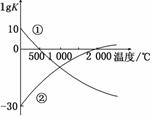
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时,将6 mol A和8 mol B充入2 L密闭容器中,发生反应:A(g)+3B(g)C(g)+D(g),容器中B的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,B的物质的量随时间的变化。下列说法正确的是( )
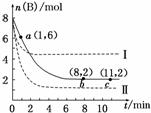
A.反应开始至a点时v(A)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应的ΔH>0
C.曲线Ⅱ对应的条件改变是增大压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种化合物,各取40g相混合,完全反应后,得18g B,49g C,还有D生成.已知D的式量为106.现将22gA和11gB反应,能生成D()
| A. | 1mol | B. | 0.5mol | C. | 0.275mol | D. | 0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有H2和CO(体积比为1:2)的混合气体V L,完全燃烧时,所需要同条件O2的体积为()
| A. | 3V L | B. | 2V L | C. | V L | D. | 0.5V L |
查看答案和解析>>
科目:高中化学 来源: 题型:
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
 A.X、W、Z元素的原子半径及它
A.X、W、Z元素的原子半径及它 们的气态氢化物的热稳定性均依次递增
们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com