
| 选 项 | 操作及现象 | 溶 液 |
| A | 加入NaOH,溶液产生蓝色沉淀.再加入葡萄糖,加热,产生红色沉淀. | CuSO4溶液 |
| B | 加入NaOH,溶液产生白色沉淀.再通入CO2,白色沉淀消失. | Ca(HCO3)2溶液 |
| C | 加入NaOH,溶液紫色褪去.再加入盐酸,振荡,溶液又变成紫色. | I2的CCl4溶液 |
| D | 加入NaOH,溶液产生白色沉淀,有刺激性气味气体产生.继续加入 NaOH,沉淀消失. | KAl(SO4)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.含醛基的物质能与新制的氢氧化铜反应;
B.碳酸氢钙与氢氧化钠反应生成碳酸钙沉淀;
C.碘单质与氢氧化钠反应生成碘化钠和次碘酸钠;
D.铝离子与氢氧化钠反应生成氢氧化铝沉淀.
解答 解:A.葡萄糖含有醛基,含醛基的物质能与新制的氢氧化铜反应,故A正确;
B.碳酸氢钙与氢氧化钠反应生成碳酸钙沉淀,碳酸钙能与二氧化碳、水反应生成碳酸氢钙,故B正确;
C.碘单质与氢氧化钠反应生成碘化钠和次碘酸钠,碘化钠和次碘酸钠在酸性条件下反应生成碘单质,故C正确;
D.铝离子与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能与氢氧化钠反应生成偏铝酸钠,无气体生成,故D错误.
故选D.
点评 本题考查较为综合,涉及元素及其化合物的性质等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 该过程说明KMnO4酸化时不能滴加盐酸 | |
| C. | 反应过程中转移2mol电子时,产生Cl2的体积约为22.4L | |
| D. | 若把该反应设计成原电池,则正极反应为MnO4-+5e-+8H+═Mn2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
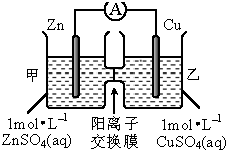
| A. | 锌电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,甲池溶液的总质量增加 | |
| D. | 该装置将化学能转化为电能,一段时间后,装置内的电子总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 讨论 | B. | 调查 | C. | 观察和实验 | D. | 上网 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com