
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+、NO3-、Na+、Cl- | B. | Mg2+、Na+、CH3COO-、Cl- | ||
| C. | SO42-、HCO3-、K+、Na+ | D. | Ba2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
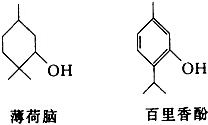 下列物质是几种常见香精的主要成分:
下列物质是几种常见香精的主要成分: .
.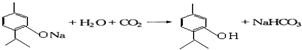 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 起始状态 | 平衡时HBr物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| (1) | 2 | 4 | 0 | 2a |
| (2) | 0 | 0.5 | 1 | 0.5a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 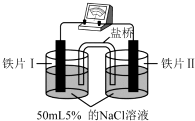 | 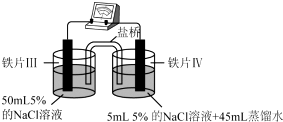 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 | |
| C. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等 | |
| D. | 铁片Ⅳ的电极反应式为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1.
CO+3H2. 在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)?CO2(g)+H2(g)来实现.己知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于5.8:1. 6xH2O+(2x+3)N2.
6xH2O+(2x+3)N2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com