
| A. | 0.2 mol | B. | 0.5 mol | C. | 2 mol | D. | 5 mol |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
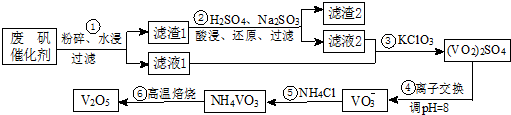
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
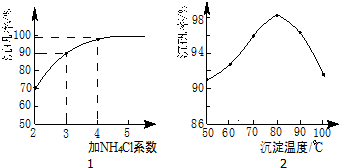
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2O(l)△H=-44kJ/mol,所以该过程是放热反应 | |
| B. | 人类利用的能源都是通过化学反应获得的 | |
| C. | 2CO(g)+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2(g)△H<0,则56gCO和32gO2所具有的总能里大于88g所具有的总能量 | |
| D. | 需要加热的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

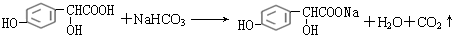 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入到BaCl2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | 浓H2SO4与硫化亚铁制取H2S气体:H2SO4+FeS=Fe2++SO42-+H2S↑ | |
| C. | SO2使溴水褪色:SO2+2H2O+Br2=4H++SO42-+2Br- | |
| D. | 氯化铵固体与熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
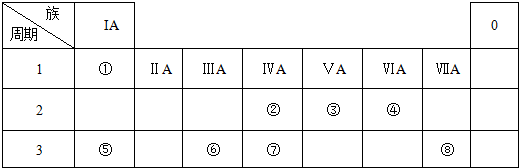
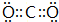 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21% | B. | 25% | C. | 30% | D. | 35% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
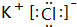
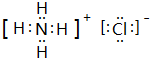 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com