
| A、氯酸钾、碳单质、液态氯化钠、液氨、王水 |
| B、双氧水、稀有气体、碱式碳酸镁、硫酸铜溶液、明矾 |
| C、烧碱、纯碱、火碱、天然气、乙酸 |
| D、二氧化锰、硫单质(S8)、NH3?H2O、纯净空气、H2O和D2O组成的混合物 |


科目:高中化学 来源: 题型:
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )| A、K与N相接时,电解池密度增大 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的b极为负极 |
| D、K与M相接时,阳极附近的pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HCOOH) |
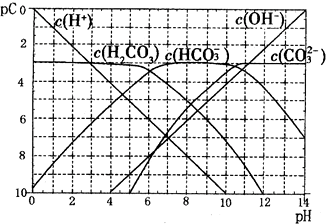
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
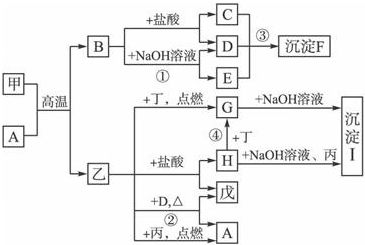 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中的阳极反应为:[Fe(CN)6]2--e-=[Fe(CN)6]3- |
| B、电解过程中阴极附近溶液的pH降低 |
| C、电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D、该处理方法理论上不需要补充电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
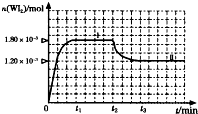 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.| c(WI2) |
| c(W)?c(I2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| V | Y | ||
| U | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com