
|
一定温度、一定体积的某密闭容器中,对可逆反应A(S)+3B(g) | |
| [ ] | |
A. |
M的生成速率与M的消耗速率相等 |
B. |
单位时间内消耗a mol B,同时生成a mol D |
C. |
容器内的压强不再变化 |
D. |
混合气体的物质的量不再变化 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
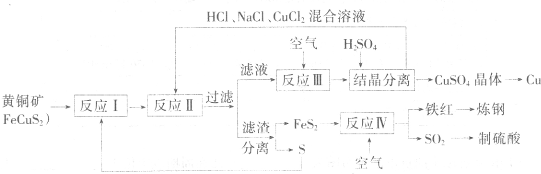
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
(2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| c2(NH3) |
| c3(H2)×c(N2) |
| c2(NH3) |
| c3(H2)×c(N2) |
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
查看答案和解析>>
科目:高中化学 来源:四川省模拟题 题型:填空题
 CH3OH(g);△H=-90.7 kJ/mol;
CH3OH(g);△H=-90.7 kJ/mol;  CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;
CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;  CO2(g)+H2(g);△H=-41.2kJ/mol。
CO2(g)+H2(g);△H=-41.2kJ/mol。 CH3OCH3(g) +CO2(g),则该反应的△H=____________
CH3OCH3(g) +CO2(g),则该反应的△H=____________  CH3OCH3(g) +3H2O(g);
CH3OCH3(g) +3H2O(g);
 SiHCl3(l)+ H2(g);
SiHCl3(l)+ H2(g); Si(纯) +3HCl。
Si(纯) +3HCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com