
反应A(g)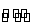 B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如下图所示。回答下列问题:
B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如下图所示。回答下列问题:
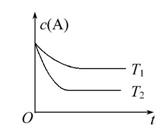
(1)上述反应的温度T1________T2,平衡常数K(T1)________K(T2)。(填“大于”“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________。
②反应的平衡常数K=________。
③反应在0~5 min区间的平均反应速率v(A)=_________。
【解析】(1)温度越高反应速率越快,到达平衡的时间越短,根据图像可知T1小于T2。由图像看出温度越高,到达平衡时c(A)越小,说明升高温度平衡向着正反应
方向移动,即正反应为吸热反应,K(T1)小于K(T2)。
(2)
A(g) 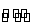 B(g) + C(g)
B(g) + C(g)
初始浓度
(mol·L-1) 0.050 0 0
改变量
(mol·L-1) 0.050×70% 0.050×70% 0.050×70%
平衡浓度
(mol·L-1) 0.015 0.035 0.035
①平衡时体系总的物质的量为(0.015+0.035+0.035)mol·L-1×1.0 L=0.085 mol。
②反应的平衡常数K=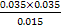 ≈0.082。
≈0.082。
③v(A)=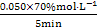 =0.007 mol·L-1·min-1。
=0.007 mol·L-1·min-1。
答案:(1)小于 小于 (2)①0.085 mol ②0.082 ③0.007 mol·L-1·min-1


科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是( )
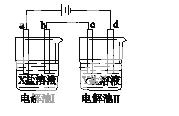
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极进行下列电解,有关说法正确的是( )
①电解稀硫酸 ②电解CuSO4溶液 ③电解KOH溶液 ④电解NaCl溶液
A.电解进行一段时间后四份溶液的pH均增大
B.②中电解一段时间后,向溶液中加入适量的CuO固体可使溶液恢复电解前的情况
C.③中阳极消耗OH-,故溶液浓度变小
D.④中阴、阳两极上产物的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应平衡常数表达式为K= 。达到平衡状态时,如果升高温度(其他条件不变),则c(NO)减小。下列说法正确的是
。达到平衡状态时,如果升高温度(其他条件不变),则c(NO)减小。下列说法正确的是
( )
A.反应的热化学方程式为NO2(g)+SO2(g)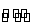 NO(g)+SO3(g) ΔH>0
NO(g)+SO3(g) ΔH>0
B.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C.混合气体的平均摩尔质量保持不变,说明反应已达平衡
D.使用合适的催化剂可使该反应的反应速率和平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是 10ml 量筒的一部分,数字XY之间相差 2mL
若 X=6,则量筒所盛液体的体积是
A. 5.2 ml B. 4.3 ml C.4.6 ml D.7.4 ml
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
保护环境是每一个公民的责任。下列做法有利于保护环境的是:①推广使用无磷洗衣粉; ②城市垃圾分类处理;③推广使用一次性木质筷子; ④推广使用清洁能源; ⑤大量使用化肥、农药。
A.①④⑤ B.②③④ C.①②④ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com