
氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大 B.氨水中的NH3·H2O电离出少量的OH-
科目:高中化学 来源: 题型:
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是( )
A. 滤液A中的阳离子为Fe3+、Cu2+、H+
B. 样品中Fe元素的质量为2.24 g
C. 样品中CuO的质量为4.0 g
D. =896 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
人类的生活、生产离不开水
(1)自然界中的水都不是纯净物,自来水厂利用沉淀、吸附、 和消毒等方法净化水。
(2)游泳池常用二氧化氯(ClO2)做消毒剂,该化合物中氯元素化合价是 价
(3)写出电解水反应的文字表达式或符号表达式 ______ ,该反应属于(填基本反应类型) 反应。
(4)完成铁丝在氧气中燃烧实验时,需在集气瓶中装少量水,其作用是
查看答案和解析>>
科目:高中化学 来源: 题型:
石油是工业的血液,主要是由多种烃组成的混合物。
(1)通常用于衡量一个国家石油化工发展水平的标志是________。
A.石油的产量 B.乙烯的产量
C.天然气的产量 D.汽油的产量
(2)从石油分馏可得到熔沸点依次________的石油气、汽油、煤油、柴油、石蜡、沥青等多种产品;工业上获得乙烯的主要方法是________。
(3)石蜡是一种从石油分馏中得到的固体,用氯气漂白过的石蜡燃烧时会产生HCl气体,这是由于石蜡漂白时与氯气发生了________。
A.加成反应 B.取代反应
C.燃烧反应 D.物理溶解
(4)石油燃烧会产生的环境污染问题主要是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业中硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。线路①②③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
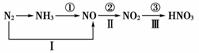
完成下列反应方程式:
写出①的化学方程式:____________________________________________________。
写出Ⅲ的化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用H2和N2直接合成氨:N2+3H22NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度
④增大压强
A.只有①②③ B.只有①②④
C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度、压强和催化剂条件下,把N2和H2按13(体积比)混合,当反应达到平衡时,混合气体中NH3占25%(体积比),求:
(1)N2的转化率__________________;
(2)反应前后体积之比__________________;
(3)平衡混合气的平均相对分子质量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)已知Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 + H2O 。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
其他条件不变时:探究浓度对化学反应速率的影响,应选择____________。(填实验编号);
探究温度对化学反应速率的影响,应选择____________。(填实验编号)。
(2)甲同学设计如下实验流程探究Na2S2O3的化学性质。
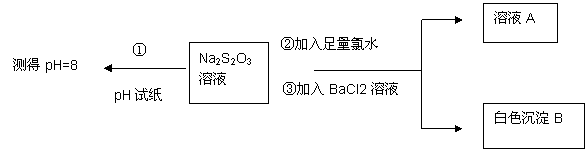
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和____________ 性。
(Ⅱ)生成白色沉淀B的离子方程式是 ____________。
(Ⅲ)已知Na2S2O3溶液与Cl2反应时, 1mol Na2S2O3转移8 mol电子。该反应的离子方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com