
CO2、CS2、COS是由C、O、S三种元素形成的结构相似的化合物。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是_____________(填序号)
A.亚硫酸溶液加入Na2CO3溶液中,产生气泡
B.氧化性:浓H2SO4>H2CO3
C.CS2中碳元素为+4价,硫元素为—2价
D.SO2有较强还原性,而CO2无还原性
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。
① 羰基硫的结构式为:________________。沸点:CO2_________COS(填“大于”或“小于”),说明原因_____________________。
②下列有关羰基硫的推测肯定不正确的是_________________
A.COS分子中,所有原子都满足8电子的稳定结构
B.COS分子是含有极性键的非极性分子
C.COS分子中三个原子处于同一直线上
D.COS可能在O2中燃烧
③ 羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下图:

已知A是一种盐,则A的化学式为________;气体单质a为____________________.
(3)在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为CO(g)+H2S(g) COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
COS(g)+H2(g),反应前CO和H2S的物质的量均为10mol,平衡后CO的物质的量为8mol,回答下列问题:
①升高温度,H2S浓度增加,表明该反应是__________________反应(填“放热”或“吸热”)。
②平衡时,继续通入CO10mol和H2S10mol,一段时间后再次达到平衡,此时H2S的转化率_____(填“增大”“减小”或“不变”)
(4)若反应在恒容密闭容器中进行,能说明该反应已达到平衡状态的是____________
A.容器内气体密度保持不变
B.CO、H2S、COS、H2的浓度均不再变化
C.c(H2)=c(H2S)
D.v(H2)正=v(H2S)逆
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2015-2016学年江西省高一下学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
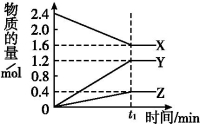
(1)该反应的化学方程式是 。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+2SO32-→I-+2SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)
④I2+SO32-+H2O→2I-+SO42-+2 H+(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。(填“①、②、③、④”)。
(2)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,才会使淀粉变蓝的现象产生。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:填空题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:

(1)①写出铜帽溶解过程中发生反应的化学方程式 。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2 =2I-+
=2I-+
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会 (填“偏高”、“偏低”、“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。
由回收铜后的滤液制备ZnO的实验步骤依次为:
① ;
② ;
③ 过滤;
④ ;
⑤ 过滤、洗涤、干燥
⑥ 900℃煅烧。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:选择题
化学与环境、材料等关系密切,下列说法正确的是
A.计算机芯片的主要成分是二氧化硅
B.碘盐能防治碘缺乏病,但必须科学合理摄入
C.用电镀废水直接灌溉农田,可提高水资源的利用率
D.CO2是导致酸雨发生的主要原因
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省怀化市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于淀粉和纤维素的说法正确的是
A.二者都能水解,但水解的最终产物不同
B.二者都属于糖类,且都是高分子化合物
C.二者含C、H、O三种元素的质量分数相同,且二者互为同分异构体
D.二者的化学性质相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
对于可逆反应2SO2(g)+O2(g)==2SO3(g);△H<0,在一恒容容器,由SO2和O2开始反应,下列说法正确的是
A.充入N2容器内压强增大,增加了单位体积内活化分子数,反应速率加快
B.反应进行的净速率是正、逆反应速率之差
C.O2的消耗速率与SO3的生成速率之比为2:1
D.加入SO2,可使单位体积内活化分子百分比增多,加快反应速率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
铀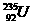 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀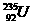 的说法正确的是
的说法正确的是
A. 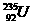 与
与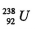 的性质完全相同
的性质完全相同
B. 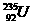 原子核中含有143个中子
原子核中含有143个中子
C. 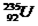 属于短周期元素
属于短周期元素
D. 1mol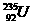 的质量是143g
的质量是143g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知:① 2CO(g)+O2(g) 2CO2(g) △H=-566kJ/mol;
2CO2(g) △H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是

A.CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g
B.如上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO的燃烧热为-566 kJ/mol
【答案】A
【解析】
试题分析:A.将①×1/2+②,整理可得CO(g)+Na2O2(s)= Na2CO3(s) △H=-509kJ/mol,即1molCO发生该反应放出热量是509kJ,现在放出热量就是509kJ,则消耗CO的物质的量是1mol,其质量是28g,正确; B.CO生成CO2的反应是放热反应,反应物的能量,图示没有注明物质的状态,不能体系能量变化关系,错误;C.根据反应可知2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ/mol,若CO2是固体,由于能量比气体低,反应放出的热量小于452 kJ,故2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452 kJ/mol,错误;D.燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,根据①可知CO的燃烧热是-283kJ/mol,错误。
考点:考查反应热的有关计算的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
在一定温度下,可逆反应2A(g)+B(g)  C(g)+D(g)达到平衡状态的标志是
C(g)+D(g)达到平衡状态的标志是
A.C的生成速率和B的消耗速率相等
B.v正(A)=2v正(B)
C.2v正(A)=v逆(B)
D.反应混合物中A、B、C、D的质量分数不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com