
【题目】硝化细菌可将NH4+转化为NO3-,发生反应NH4++2O2→NO3-+2H++H2O,下列说法错误的是
A.氧化剂与还原剂的物质的量之比为2:1
B.反应一段时间后,溶液的酸性增强
C.1molNH4+完全反应,转移电子的物质的量为8mol
D.NO3-既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物
科目:高中化学 来源: 题型:
【题目】2HI(g) ![]() H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
H2(g)+I2(g)反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。
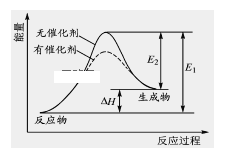
下列有关叙述正确的是 ( )
A.升高温度,反应速率增大,△H减小
B.升高温度,不影响活化分子百分数
C.逆反应的活化能等于正反应的活化能
D.催化剂能降低该反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇( )广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
)广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
(1)关于它的说法正确的是________。
a.可使酸性KMnO4溶液褪色
b.可与FeCl3溶液作用显紫色
c.可使溴的CCl4溶液褪色
d.可与NH4HCO3溶液作用产生气泡
e.它属于醇类
(2)1 mol 该化合物最多消耗________ mol NaOH。
(3)1 mol 该化合物与Br2反应时,最多消耗________ mol Br2。
(4)1 mol该化合物与H2加成时,最多消耗标准状况下的H2的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图及操作步骤如下:

请回答下列问题:
(1)装置A中g管的作用是___;装置B中的试剂是___;E处左方选用较粗玻璃管的原因是___;装置F中盛碱石灰干燥管的作用是___。
(2)检验装置的气密性;点燃A处的酒精灯。写出装置A中发生反应的离子方程式___。
当h中充满黄绿色气体时点燃D处铁屑下方的酒精灯。反应结束,将收集器h密封。
(3)检验收集器h收集到的是FeCl3而木是FeCl2步骤是:①取收集器中的少量样品溶于少量浓盐酸,加水稀释,将溶液分为两份;②一份溶液检验出三价铁离子;③另一份溶液不能检验出二价铁离子。
①中盐酸的作用是___;②中检验出三价铁离子的离子方程式___。③检验无二价铁离子的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO![]() +N2H
+N2H![]() +3H+
+3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
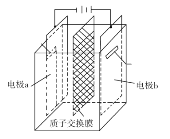
A.电解液中NO![]() 的移动方向:a极→质子交换膜→b极
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO![]() +2H2O+2e-=U4++4OH-
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=akJ·mol-1
4N2(g)+6H2O(g) △H1=akJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) △H2=bkJ·mol-1
3N2(g)+6H2O(g) △H2=bkJ·mol-1
副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H4=dkJ·mol-1
4NO(g)+6H2O(g) △H4=dkJ·mol-1
可以计算出反应2NO(g)+O2(g)![]() 2NO2(g)的△H为( )
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)![]() S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
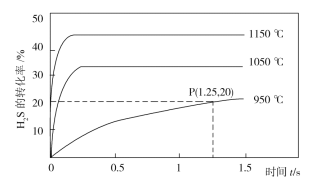
①温度升高时,混合气体的平均摩尔质量减小的原因是___。
②P点时容器内气体压强与起始时气体压强之比为___。
③1050℃时,此反应的平衡常数___(填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为___。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:

①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com