
 ,则氧化性:A2 > D2
,则氧化性:A2 > D2科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. | B. | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:I2>Cu2+>SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
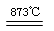 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是| A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI |
| C.KClO3和KIO3均属于离子化合物,都只含有离子键 |
| D.制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
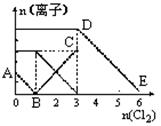
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1: 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性: B2> A2 | B.还原性: C- > D- |
| C.2A- +D2 =2D- + A2反应可以进行 | D.2C- +B2 =2B- + C2反应不能进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Br2在反应中被氧化 |
| B.SO2在反应中表现还原性 |
| C.H2SO4是还原产物 |
| D.1 mol氧化剂在反应中失去2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com