
| A. | 氯化氢气体溶于水 | B. | 白磷在一定条件下转化为红磷 | ||
| C. | 碘在加热条件下升华 | D. | 氯化钠晶体加热熔化 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
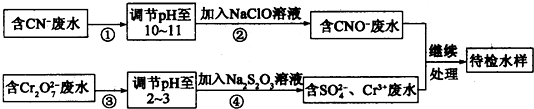
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建筑使用了大量钢材,钢材是纯铁 | |
| B. | 明矾与水反应生成氢氧化铝胶体能吸附水中悬浮物,可用于水的净化 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用焰色反应可鉴别K2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 明矾溶液中滴加Ba(OH)2溶液至SO42-恰好完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
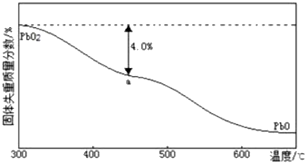
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
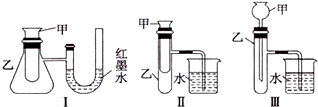
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com