
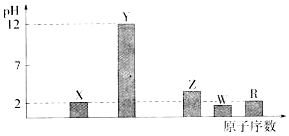
���� Ԫ�صĽ�����Խǿ�����Ӧ����������ˮ�������Խǿ�����Һ��pHԽ��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ�����Һ��pHԽС��Ũ�Ⱦ�Ϊ0.01mol��L-1������ͼ��֪������������Ӧ��ˮ���X��R��Ϊ����ΪһԪǿ�ᣬYΪһԪǿ�Z��WΪ��Ԫ�ᣬ��Ӧ��ԭ���������������ԣ�X��Y��Z��W��R�ֱ�ΪN��Na��P��S��ClԪ�أ�
��1��R��ClԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȣ�����������������������ȣ�
��2��Ԫ��Y��W�γɵ�Y2W2�ͻ�����ΪNa2S2���������Ӽ����Ǽ��Թ��ۼ���
��3��X��һ���������Ƕ�������������������ˮ��Ӧ���������NO��
��� �⣺Ԫ�صĽ�����Խǿ�����Ӧ����������ˮ�������Խǿ�����Һ��pHԽ��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ�����Һ��pHԽС��Ũ�Ⱦ�Ϊ0.01mol��L-1������ͼ��֪������������Ӧ��ˮ���X��R��Ϊ����ΪһԪǿ�ᣬYΪһԪǿ�Z��WΪ��Ԫ�ᣬ��Ӧ��ԭ���������������ԣ�X��Y��Z��W��R�ֱ�ΪN��Na��P��S��ClԪ�أ�
��1��R��ClԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȣ�����������������������ȣ�Clԭ�Ӻ�����3�����Ӳ㡢������������7������λ�ڵ������ڵ�VIIA�壬�ʴ�Ϊ���������ڵ�VIIA�壻
��2��Ԫ��Y��W�γɵ�Y2W2�ͻ�����ΪNa2S2�������ʽΪ��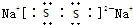 ���������Ӽ����Ǽ��Թ��ۼ���
���������Ӽ����Ǽ��Թ��ۼ���
�ʴ�Ϊ�����Ӽ����Ǽ��Թ��ۼ���
��3��X��һ���������Ƕ�������������������ˮ��Ӧ���������NO����Ӧ����ʽΪ3NO2+H2O=2HNO3+NO��
�ʴ�Ϊ��3NO2+H2O=2HNO3+NO��
���� ���⿼��ԭ�ӽṹ��Ԫ�����ʣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������ƶ������������ƶ�Ԫ���ǽⱾ��ؼ���֪���������ʽṹ�����ʣ�ע�⣺����������ˮ��Ӧ���������ͻ�ԭ�����Ƕ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �кͷ�Ӧʱ����һ���������������仯 | |
| B�� | ���е�ȼ�շ�Ӧ���Ƿ��ȷ�Ӧ | |
| C�� | ֻҪ�������仯�Ķ��ǻ�ѧ�仯 | |
| D�� | �κη�Ӧ�е������仯������Ϊ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ױ���ˮ | B�� | �������ˮ | C�� | ��������ˮ | D�� | ��������屽 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+��=2c��S2-��+2c��HS-��+2c��H2S�� | B�� | c��Na+��+c��H+��=c��OH-��+c��HS-��+2c��S2-�� | ||
| C�� | c��Na+����c��S2-����c��OH-����c��HS-�� | D�� | c��OH-��=c��H+��+c��HS-��+c��H2S�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com