
| A.1∶4 | B.2∶7 |
| C.1∶2 | D.8∶31 |
科目:高中化学 来源:不详 题型:实验题
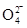 )。
)。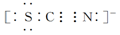
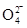 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
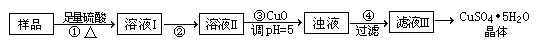
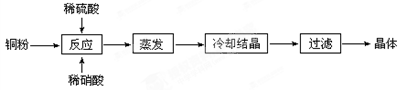
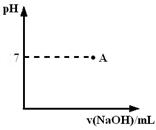
| A.醋酸 | B.草酸 | C.苯甲酸 | D.苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+ |
| B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+ |
| C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快 |
| D.溶液中出现的黑色物质可能是氧化铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
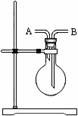
| A.Fe | B.FeCl3 | C.FeSO4 | D.Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
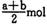 B (a — b) mol
B (a — b) mol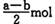 D. (a+b) mol
D. (a+b) mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.肯定有Fe2+,可能有Fe3+ | B.肯定有Fe3+,一定没有Cu2+ |
| C.肯定有Cu2+,一定没有Fe3+ | D.肯定有Fe2+,一定没有Fe3+和Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com