
 2NH3���ﵽƽ���÷�Ӧ�ų�������Ϊ18.4kJ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%��
2NH3���ﵽƽ���÷�Ӧ�ų�������Ϊ18.4kJ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%�� 2NH3(g) ��H����92.0kJ/mol (3) 0 mol��c��0.4mol
2NH3(g) ��H����92.0kJ/mol (3) 0 mol��c��0.4mol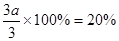 ��
�� 2NH3(g) ��H����92.0kJ/mol��
2NH3(g) ��H����92.0kJ/mol��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bB(��) + cC(��), ���¶Ȳ����������,�ٳ���һ������A����, ���´ﵽƽ��ʱ, �����ж�����ȷ����:��������
bB(��) + cC(��), ���¶Ȳ����������,�ٳ���һ������A����, ���´ﵽƽ��ʱ, �����ж�����ȷ����:��������| A����a =" b" + c, B�����ʵ���������� | B���� a =" b" + c , B �����ʵ���������С |
| C����a > b + cʱ, A��ת���ʲ��� | D���� a < b + cʱ , A��ת���ʱ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)�ﵽ��ѧƽ��״̬�ı�־��
2C(g)�ﵽ��ѧƽ��״̬�ı�־���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe(SCN)3��Һ�м������KSCN����ɫ���� |
| B���غ�ɫNO2��ѹ����ɫ�ȱ�����dz |
| C��H2��I2��HIƽ��������ѹ����ɫ���� |
| D����ơ��ƿ�ǣ�ƿ��ð���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
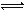 Z(g)����60s�ﵽƽ�⣬����0.3 mol Z��������ȷ����( )
Z(g)����60s�ﵽƽ�⣬����0.3 mol Z��������ȷ����( )| A��60s����XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol/(L��s) |
| B�������������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����1/2 |
| C��������ѹǿ��������Y��ת���ʼ�С |
| D���������¶ȣ�X�������������������Ӧ��DH��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3C(g)���ﵽƽ�������1.5 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ1.2 mol��
3C(g)���ﵽƽ�������1.5 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ1.2 mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g��;
2NH3(g��;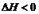 ,10minʱ�����ʵ�Ũ�Ȳ��ٱ仯�����NH3�����ʵ���Ϊ0.4mol��
,10minʱ�����ʵ�Ũ�Ȳ��ٱ仯�����NH3�����ʵ���Ϊ0.4mol��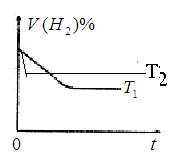

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com