
| A. | Al2O3→Al(OH)3 | B. | CaCO3→Ca(OH)2 | C. | CH3CH2OH→CH3CHO | D. | CO→Na2CO3 |
分析 A.Al2O3和水不反应;
B.CaCO3和碱不反应;
C.催化作用下乙醇可被氧化生成乙醛;
D.CO属于不成盐氧化物.
解答 解:A.Al2O3和水不反应,Al2O3和强酸或强碱反应生成可溶性盐,铝盐和弱碱反应生成氢氧化铝、偏铝酸盐溶液和CO2反应生成Al(OH)3,所以Al2O3不能一步生成Al(OH)3,故A错误;
B.CaCO3和碱不反应,CaCO3分解生成CaO,CaO和水反应生成Ca(OH)2,所以CaCO3不能一步生成Ca(OH)2,故B错误;
C.在铜或银催化作用下,乙醇可被氧化生成乙醛,故C正确;
D.CO属于不成盐氧化物,所以CO不能一步反应生成Na2CO3,故D错误;
故选C.
点评 本题考查了物质之间的转化,为高频考点,侧重元素化合物知识的综合理解和运用的考查,明确物质的性质是解本题关键,根据物质之间的反应来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
在试管加少量的吸收液,再滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,则说明假设1成立,否则假设1不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 | 甲、乙两种分子一定是同分异构体 |
| C | 致冷剂氟里昂(二氯二氟甲烷)不存在同分异构体 | 甲烷分子为正四面体构型 |
| D | 将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 | 使KMnO4褪色的一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
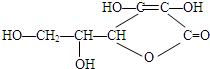 有机化合物的化学性质本质上就是分子结构中所含官能团的性质:
有机化合物的化学性质本质上就是分子结构中所含官能团的性质: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
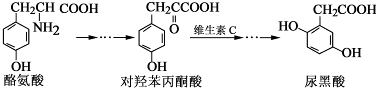
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com