
 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药),因为具有潜在致癌性,已被禁止使用.下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿属于烃 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
分析 A.该分子的结构可看作是甲烷中的氢原子被其它的原子团取代,根据甲烷的结构判断该分子的结构;
B.含有N元素,属于烃的衍生物;
C.不含碳碳双键,与溴水不发生加成反应;
D.在一定条件下,能与氢气发生加成反应的是苯环.
解答 解:A.该分子的结构可看作是甲烷中的氢原子被其它的原子团取代而生成的化合物,甲烷中的所有原子不再同一平面上,所以该分子中的所有的碳原子不可能在同一平面上,故A错误;
B.含有N元素,属于烃的衍生物,不属于烃,故B错误;
C.该分子中不含能与溴水反应的官能团,所以不与溴发生加成反应,故C错误;
D.1mol无色孔雀石绿3mol苯环,所以在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及有机反应,题目难度不大.


科目:高中化学 来源: 题型:填空题
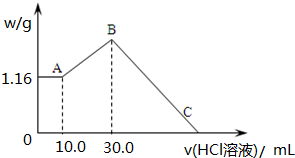
 将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:
将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁在潮湿的空气中易发生化学腐蚀而锈蚀 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 在米汤中加入食盐,可以检验食盐中是否加碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | 因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应不再进行 | B. | 反应物浓度等于生成物浓度 | ||
| C. | 正反应速率不等于逆反应速率 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 3mol铁与足量的水蒸气充分反应,转移8NA个电子 | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com