
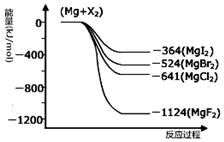
 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应. 科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与氧气反应,条件不同产物不同 | |
| B. | 金属钠着火可用水扑灭 | |
| C. | 少量的钠可保存在汽油里 | |
| D. | 钠的化学性质活泼,可从硫酸铜溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | A | B | C | D | E | F | G | H | I |
| 原子半径/nm | 0.037 | 0.071 | 0.074 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高或最 低化合价 | +1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
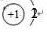 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
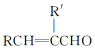 +H2O
+H2O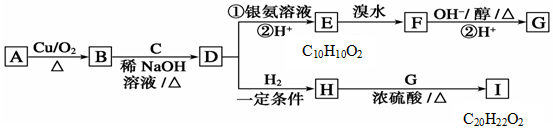
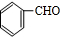 ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基.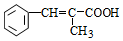 +
+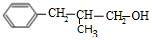 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$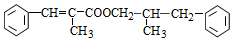 +H2O.
+H2O.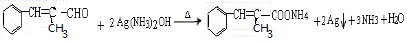 .
.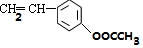 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
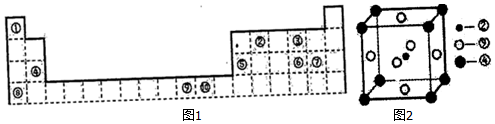
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
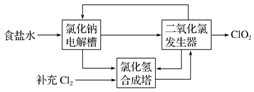 某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.
某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
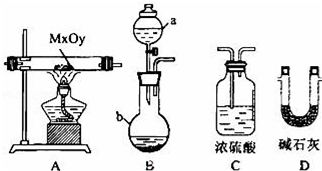
| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com