
���ݻ���ͬ�ļס����ܱ�������Ͷ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£���֪N2(g) + 3H2(g)  2NH3(g) ��H����92��4 kJ��mol
2NH3(g) ��H����92��4 kJ��mol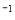 ����
����
| ��Ӧ��Ͷ���� | NH3��Ũ�� ��mol��L | ��Ӧ�� �����仯 | ��ϵѹǿ ��Pa�� | ��Ӧ�� ת���� |
�� | 1mol N2��3mol H2 | c1 | �ų�a kJ | p1 | ��1 |
�� | 2mol NH3 | c2 | ����b kJ | p2 | ��2 |
����˵����ȷ���ǣ� ��
A��c1 = c2 B��a + b = 1 C��p1��p2 D����1 +��2��1
A
��������
����������״�����Ӧ����ʼ���Ҵ��淴Ӧ����ʼ�����ڷ�Ӧ������ͬ���������ݻ���ȣ�����һ�ߵ�ת��������ʵ�����ͬ����˴ﵽƽ��ʱ����Ϊ��Чƽ�⡣��˴ﵽƽ��ʱc1 = c2��A��ȷ������ת����ϵ��a+b=92��4 kJ/mol��B���������ǵ�Чƽ�⣬���Է�Ӧ�ﵽƽ��ˮ��ϵ��ѹǿ��ȡ���p1=p2 ���������淴Ӧ�����������෴�ķ���ʼ����ʱ����Ӧ���ת���ʻ�Ϊ������ϵ������1 ����2=1������
���㣺������淴Ӧ�����������෴�ķ���ʼ�ﵽƽ��ʱ�����ʵ�Ũ�ȡ�ת���ʡ�ѹǿ�������Ĺ�ϵ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ��и���������9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��1L1mol��L��1��NaClO ��Һ�к���ClO������ĿΪNA
B��78g ������C��C˫������ĿΪ3NA
C�����³�ѹ�£�14g��N2��CO��ɵĻ�����庬�е�ԭ����ĿΪNA
D����״���£�6.72L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱���и���8�¿�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ȳ���������M�Ľṹ��ʽ��M��ϡ���������µ�ˮ�ⷴӦ��ͼ��ʾ�������й�˵������ȷ����

A��M��A����ʹ���Ը��������Һ����ˮ��ɫ
B��B�к����Ȼ����ǻ����ֹ����ţ��ܷ�����ȥ��Ӧ��������Ӧ
C��1 mol M���ȵ��ռ���Һ��Ӧ��������2n mol NaOH
D��A��B��C��1 mol�ֱ�������Ʒ�Ӧ���ų���������ʵ���֮��Ϊ1��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱���и���8�¿�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Լ�ʻԱ�Ƿ����ƽ��м���ԭ���dz�ɫ������K2Cr2O7ˮ��Һ���������Ҵ�����Ѹ�ٱ�������������ɫ��Cr3�������ж��Ҵ���������˲ⶨԭ���йص���
���Ҵ��е�͡� ���Ҵ��ܶȱ�ˮС�� ���Ҵ����л�ԭ�ԡ�
���Ҵ������ĺ�����������Ҵ�����������Ũ����������·���ȡ����Ӧ
A���ڢ� B���ڢ� C���٢� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų����Ԫ��ɽ���߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧʵ��С����г�������һƿijƷ��ʳ�ð״ף���Ҫ�Ǵ����ˮ��Һ������ʵ���ұ�NaOH��Һ������еζ��Բⶨ����ȷŨ�ȡ��±���4�ֳ���ָʾ���ı�ɫ��Χ��
ָʾ�� | ʯ�� | ���� | ���� | ��̪ |
��ɫ��Χ��pH�� | 5��0��8��0 | 3��1��4��4 | 4��4��6��2 | 8��2��10��0 |
��1����ʵ��Ӧѡ�� ��ָʾ����
��2����ͼ��ʾ50mL�ζ�����Һ���λ�ã���A��C�̶ȼ����1mL��A���Ŀ̶�Ϊ25���ζ�����Һ�����ӦΪ mL����Ӧ��ζ��յ�ʱ������Ϊ ��

��3��Ϊ��Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡ�״������ΪVmL��NaOH��ҺŨ��Ϊc mo1/L������ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����NaOH��Һ���/mL | 26��02 | 25��35 | 25��30 |
���ϱ����Կ�������һ��ʵ���м�¼����NaOH��Һ��������Զ��ں����Σ���ԭ������� ��
A��ʵ�����ʱ�����ӿ̶��߶�ȡ�ζ��յ�ʱNaOH��Һ�������
B���ζ�ǰ�ζ��ܼ��������ݣ��ζ��������첿�ֳ�����Һ��
C��ʢװ�״���Һ�ĵζ���������ˮϴ����δ�ð״���Һ��ϴ��
D����ƿԤ����ʳ�ð״���ϴ����
E���μ�NaOH��Һʱ��δ������տ�����Һ��ɫ������ֹͣ�ζ���
��4�������������ݣ�д������ð״��д�������ʵ���Ũ�ȵı���ʽ(���û���)��C1�� mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų����Ԫ��ɽ���߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��1�ͦ�2�ֱ�ΪA�ڼס�����������������ƽ����ϵA(g)  2B(g)��2A(g)
2B(g)��2A(g)  C(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����( )
C(g)��ת���ʣ����¶Ȳ��������£�������A�����ʵ����������ж���ȷ����( )
A����1����2����С B����1����2������
C����1��С����2���� D����1����2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų����Ԫ��ɽ���߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���������м��������ټ���(����400��)�������ʵ���Һ�����Եõ������ʹ�����ǣ� ��
A���Ȼ��� B��̼������ C���������� D������þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015������ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͭ��һ����Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��N2O4��NO�Ļ�����壬��Щ������1��68 L O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᡣ������������ͭ��Һ�м���5mol�� L-1 NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ������ǣ� ��
A��60 mL B��45 mL C��30 mL D��15 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������ѧͬ�����˽�ѡ��4��1.1.1��ѧ��Ӧ�������ı仯�������棩 ���ͣ������
�±��е��������ƻ�1 mol�����еĻ�ѧ�������ĵ�����(kJ)��
���� | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
����/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
�����������ݻش�1��~��5���⡣
��1���������ʱ������е�������͵��ǡ���������
A��H2B��Cl2 C��Br2D��I2
��2�������⻯���У����ȶ����ǡ���������
A��HCl����������B��HBr����������C��HI
��3��X2+H2 2HX(X����Cl��Br��I )�ķ�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ?�𣺡���
2HX(X����Cl��Br��I )�ķ�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ?�𣺡���
��4����ͬ�����£�X2(X����Cl��Br��I)�ֱ���������Ӧ�������ĵ����ʵ���������ʱ���ų������յ����������ǡ�����������
��5�������ϱ��е����ݣ�������ȷ�ش�����⣨4����?
�𣺡�������������ĸ����ǡ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com