
分析 (1)原电池反应中负极是铁,电极反应为Fe-2e-=Fe2+;铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu;
(2)铜片质量增加了12.8g,转移电子物质的量为$\frac{12.8g}{64g/mol}$×2=0.4mol,有0.2molFe反应,据此计算溶液质量变化;
(3)反应后生成0.2mol硫酸亚铁,据c=$\frac{n}{V}$计算溶液浓度.
解答 解:(1)铜做正极,溶液中铜离子得到电子生成铜发生还原反应,电极反应Cu2++2e-=Cu,故答案为:正;Cu2++2e-=Cu;
(2)原电池中阴离子移向负极,所以硫酸根离子移向负极Fe,生成0.2molCu,有0.2molFe溶解,溶液质量减少0.2mol×64g/mol-0.2mol×56g/mol=1.6g,故答案为:铁;1.6;
(3)反应后硫酸亚铁的物质的量浓度为$\frac{0.2mol}{0.2L}$=1mol/L,故答案为:1mol/L.
点评 本题考查了原电池原理分析、电极反应书写计算的应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
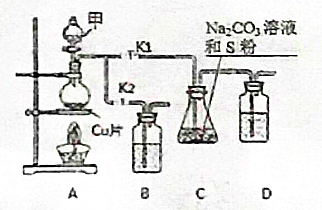 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式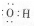 | B. | 醛基官能团符号-COH | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 异丁烷的结构简式:CH3CH(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表左下方区域的金属元素中寻找半导体材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 | |
| C. | 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有使湿润的pH试纸变蓝的气体产生 | |
| B. | 滴有水滴的玻璃片冻结在烧杯底部 | |
| C. | 盛有饱和硝酸钾溶液的试管置于反应混合物内,拿出后发现溶液浑浊 | |
| D. | 烧杯外壁有水珠凝结 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. |  N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 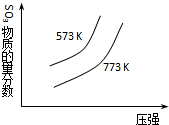 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 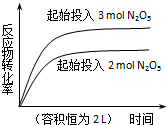 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19 | B. | 18 | C. | 27 | D. | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com