
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||||
| B. | AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||||
| C. | 钠与CuSO4溶液反应,2Na+Cu2+═Cu↓+2Na+ | ||||||||
| D. | 已知碳酸和次氯酸的电离平衡常数如下:
|
分析 A.发生氧化还原反应生成硫酸钠;
B.n(OH-):n(Al3+ )=7:2时,生成等物质的量的氢氧化铝、偏铝酸钠;
C.反应生成氢氧化铜、硫酸钠和氢气;
D.由K可知酸性碳酸>HClO>HCO3-,则碳酸钠与HClO反应.
解答 解:A.NaHSO3溶液中投入过氧化钠粉末的离子反应为2H2O+HSO3-+3Na2O2═SO42-+O2↑+5OH-+6Na+,故A错误;
B.AlCl3溶液与烧碱溶液反应,当 n(OH-):n(Al3+ )=7:2时的离子反应为2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故B正确;
C.钠与CuSO4溶液反应的离子反应为2H2O+2Na+Cu2+═Cu(OH)2↓+H2↑+2Na+,故C错误;
D.二氧化碳通入到次氯酸钠溶液中的离子反应为ClO-+CO2+H2O═HCO3-+HClO,故D错误;
故选B.
点评 本题考查离子方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、强酸制取弱酸的离子反应考查,题目难度不大,选项A为解答的难点.


科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D |
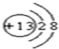
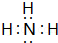 ,Y的结构式为
,Y的结构式为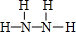 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
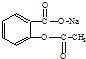 转变为
转变为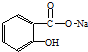 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
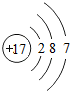 ;
; ,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目:
,该化合物的水溶液在空气中久置后变质,生成一种单质和一种强碱,用化学方程式表示这一变化过程并用单线桥标记电子转移的方向和数目: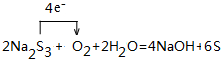
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | A | B | C | D |
| △H/(kJ•mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| △S/(J•mol-1•k-1) | 30.0 | -113.0 | 84.0 | -105.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3KJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-78.64KJ•mol-1 | |
| D. | 2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com