
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为
(2)钛能与B、C、 N、 O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”下同)B;第一电离能: N O。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3) 。 FeTiO3与80%的硫酸反应可 生成TiOSO4。SO42-的空间构型为 形,其中硫原子采用 杂化.
(4)磷酸钛〔Ti3 (PO4 )4]锂离子电池能量密度大、安全性高。Ti3 (PO4 )4可由TiOSO4与
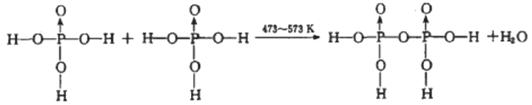 H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
H3PO4反应制得。两分子H3PO4发生脱水生成焦磷酸;
则三分子H3PO4脱去两分子H2O生成三磷酸,其结构式为 ,四分子H3PO4 脱去四分子H2O生成的四偏磷酸属于 元酸。
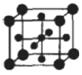
(5)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围 个O2-相紧邻.
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCI型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1)中,若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28X10-10 m,则FexO中x=_。
【知识点】晶体结构、原子的核外电子排布 E1 E4 E5
【答案解析】(1)1s22s22p63s23p63d24s2(2分)
(2)>;>(各2分)
(3)正四面体;sp3(各1分)
(4)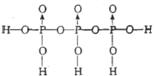 ;四(各1分)
;四(各1分)
(5)12(2分)(6)0.92(3分)
解析::(1)Ti是22号元素,原子核外有22个电子,根据构造原理知Ti基态原子的电子排布式为1s22s22p63s23p63d24s2
(2)C和B属于同一周期且C的原子序数大于B,所以电负性C>B,N原子中2p轨道处于半充满状态,O原子中2p轨道既不是半充满也不是全空或全满,所以N原子第一电离能比O原子大。
(3)SO42-中价电子数为:4+1/2(6+2-4×2)=4,且硫酸根离子中不含孤电子对,所以硫酸根离子呈正四面体构型,采用sp3杂化。
(4)仿照两分子H3PO4发生脱水生成焦磷酸,即可写出三分子H3PO4脱去两分子H2O生成三磷酸的结构式。
(5)观察CaTiO3的晶体结构发现Ti4+在正方体的顶点,O2-在正方体的面心,所以该晶体中,Ti4+周围相紧邻O2-数为:3×8×1/2=12.
(6)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,利用密度公式得: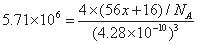 ,解得x=0.92。
,解得x=0.92。
【思路点拨】本题考查了晶体结构、原子的核外电子排布等,最后一问难度较大抓住一个晶胞的质量、体积、密度间的关系即可解答。


科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 |
|
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
|
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 |
|
| D. | 2,3一二甲基丁烷的核磁共振氢谱中会出现两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO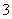 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.短周期元素W 、X、 Y、 Z的原子序数依次增大,且W 、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2 、3、 4、 2(不考虑零族元素)。下列关于这些元素的叙述错误的是 ( )
A.X和其他三种元素均可形成至少2种二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W 、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对物质的量理解正确的是()
A. 物质的量就是物质的质量
B. 物质的量是一种基本物理量
C. 物质的量就是物质的摩尔质量
D. 物质的量就是物质所含粒子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
分离四氯化碳和甲苯的混合物(两者互溶,沸点分别为76.75℃和110.6℃),可选用的分离方法为()
A. 萃取法 B. 蒸馏法 C. 结晶法 D. 分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的离子,能在溶液中大量共存的是()
A. Mg2+、H+、Cl﹣、OH﹣ B. Na+、Ba2+、CO32﹣、NO3﹣
C. Na+、H+、Cl﹣、CO32﹣ D. K+、Cu2+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 铁和稀盐酸反应2Fe+6H+═2Fe3++3H2↑
B. 硫酸和氢氧化钡溶液反应Ba2++SO42﹣═BaSO4↓
C. 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag
D. 氢氧化钠和盐酸反应:H++OH﹣═H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com