
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列溶液肯定呈酸性的是( )
A.含有H+离子的溶液 B.酚酞显无色的溶液
C.C(OH-)<C(H+)的溶液 D.pH小于7的溶液
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4===2 KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=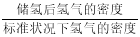 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热不会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为75%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com