
分析 (1)根据公式ρ=$\frac{m}{V}$进行判断;先分析每个分子中的质子数,再判断相同物质的量的三种分子含有的质子数;先计算分子的物质的量,再根据分子中中子数计算;先分析每个分子中的电子数,再判断相同体积的三种物质中含有的电子数;
(2)1)根据电荷守恒知,RO3n-+3S2-+6H+=R-+3S+3H2O中n=1,离子中各元素化合价的代数和等于电荷数,据此判断R元素化合价;
2)主族元素原子,最外层电子数=最高正化合价,最低负价=族序数-8.
解答 解:(1)1)密度公式为:ρ=$\frac{m}{V}$=$\frac{M}{Vm}$,相同条件下,Vm相同,所以其密度之比等于其摩尔质量之比,为1:2:3,
故答案为:1:2:3;
2)每个H2、D2、T2分子中含有的质子数都是2,物质的量相同的三种单质含有的分子数相同,含有的质子数相同,所以为:1:1:1,
故答案为:1:1:1;
3)每个H2、D2、T2分子中含有的中子数分别为0、2、4,则1g各种单质中它们的中子数之比是$\frac{1}{2}×0$:$\frac{1}{4}×2$:$\frac{1}{6}×4$=0:3:4;
故答案为:0:3:4;
4)每个H2、D2、T2分子中含有的电子数都是2,相同条件下,体积相同的三种单质中含有的电子数相等,所以比为:1:1:1,
故答案为:1:1:1;
(2)1)根据电荷守恒知,RO3n-+3S2-+6H+=R-+3S+3H2O中n=1,离子中各元素化合价的代数和等于电荷数,所以RO3-中化合价-1-(-2)×3=+5,
故答案为:+5;1;
2)R元素最低化合价为-1价,则其最高化合价为+7价,主族元素原子,最外层电子数=最高正化合价=7,最外层电子数等于其主族的族序数,所以位于第VIIA族;
故答案为:7;ⅦA.
点评 本题考查了原子的构成、物质的量的有关计算、元素的推断,题目难度不大,侧重考查基本概念、基本理论,注意不能根据方程式RO3-中R元素化合价判断最外层电子数,为易错点.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 填写下列空白:
填写下列空白: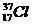 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
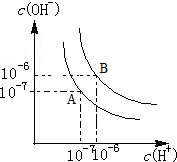 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com