

| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl和HNO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的盐类物质均为含氧酸盐 |
分析 A.目前常用的化肥分为:①氮肥,即以氮素营养元素为主要成分的化肥,如尿素、碳铵等;②磷肥,即以磷素营养元素为主要成分的化肥,如过磷酸钙;③钾肥.即以钾素营养元素为主要成分的化肥,主要品种有氯化钾,硫酸钾等;④复混肥料.即肥料中含有氮、磷、钾三要素中的两种称为二元复混肥料,含有氮、磷、钾三种元素的复混肥料称为三元复混肥料;
B.NH4Cl、HNO3受热时都易分解;
C.NO2跟NH3可以发生反应:6NO2+8NH3=7N2+12H2O;
D.NaCl不是含氧酸盐.
解答 解:A.NH4Cl是氮肥,NaHCO3不是化肥,故A错误;
B.NH4Cl受热易分解生成HCl和NH3、HNO3受热时分解生成二氧化氮、氧气和水,故B正确;
C.NO2跟NH3可以发生反应:6NO2+8NH3=7N2+12H2O,该反应为氧化还原反应,故C正确;
D.NaCl不是含氧酸盐,故D错误;
故选BC.
点评 本题考查了氮及其化合物之间的转化,明确物质的性质即可解答,熟练掌握N元素及其化合物性质,题目难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | C7H12O4,4种 | B. | C7H12O4,6种 | C. | C7H14O2,8 种 | D. | C7H14O2,10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用于消除H7N9病毒的漂白粉是一种强电解质 | |
| B. | 古代制盐(NaCl)有“东晒西煮”之说,是利用了复杂的物理、化学方法 | |
| C. | 铜带(镀锡)是光伏电池的电子元件,破损时不加快其腐蚀 | |
| D. | 纤维素、蛋白质和油脂均可发生水解,都属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CC14所含的原子数为0.5 NA | |
| B. | 0.1 mol FeCl3水解生成的Fe(OH)3胶粒数为0.1 NA | |
| C. | 将lmol Cl2通人水中,HC1O、Cl-、C1O-粒子数之和为2 NA | |
| D. | 11.2 g 铁粉与足量稀硝酸反应失去电子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Cu2+、SO42-、Cl- | ||
| C. | Al3+、Fe2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
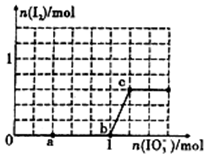 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加人KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0-a段发生反应:3 HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b段共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c段反应:氧化产物为I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:1时,加入的KIO3为1.lmol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com