
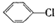
 制备
制备 步骤:
步骤: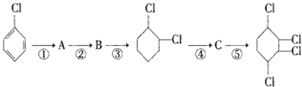
 ,B
,B ,C
,C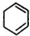
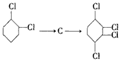 的化学方程式①
的化学方程式①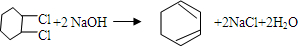 ②
②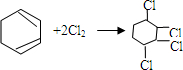 .
. 分析 由转化关系可知,氯苯与氢气发生加成反应生成A为 ,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为
,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为 ,环己烯再与氯气发生加成反应生成
,环己烯再与氯气发生加成反应生成 ,再发生消去反应生成C为
,再发生消去反应生成C为 ,
, 与氯气发生加成反应得到
与氯气发生加成反应得到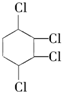 ,据此答题.
,据此答题.
解答 解:由转化关系可知,氯苯与氢气发生加成反应生成A为 ,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为
,A在氢氧化钠醇溶液、加热条件下发生消去反应生成B为 ,环己烯再与氯气发生加成反应生成
,环己烯再与氯气发生加成反应生成 ,再发生消去反应生成C为
,再发生消去反应生成C为 ,
, 与氯气发生加成反应得到
与氯气发生加成反应得到 ,
,
(1)由以上分析可知,A为 ,B为
,B为 ,C为
,C为 ,
,
故答案为: ;
; ;
; ;
;
(2)由以上分析可知①加成反应,②发生消去反应,③发生加成反应,④发生消去反应,⑤发生加成反应,
故答案为:b、c、b、c、b;
(2)反应①为氯苯催化加氢,所以反应的条件为催化剂、加热,反应②为氯代烃在NaOH的醇溶液加热可发生消去反应,故答案为:催化剂、加热;NaOH 的醇溶液加热;
(3)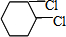 发生消去反应生成C,为
发生消去反应生成C,为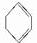 ,反应的方程式为
,反应的方程式为 ,
, 发生加成反应可生成
发生加成反应可生成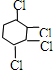 ,反应的方程式为
,反应的方程式为 ,
,
故答案为: ;
; .
.
点评 本题考查有机物的合成,题目难度不大本题注意把握有机物官能团的变化,结合反应条件判断各有机物的结构.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 一纸多用,尽量提高纸张的使用效率 | |
| B. | 回收处理,不乱扔、乱丢废纸屑 | |
| C. | 在高浓度氧气中燃烧,不产生废弃物 | |
| D. | 积累、保存送造纸厂处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
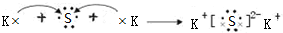 ,其化合物中化学键的类型是离子键.
,其化合物中化学键的类型是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 乙醇能和水以任意比例互溶 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性以此减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 放热反应不需要加热即可发生 | |
| C. | 放热反应常温下易发生 | |
| D. | 反应是放热还是吸热,要看反应物和生成物所具有的总能量的相对大小,不能看反应条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com