
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
分析 (1)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气;
(2)根据题中信息,铂溶于王水时产生[PtCl6]2-和一种无色气体为一氧化氮,据此写出反应的离子方程式;
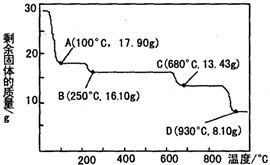
(3)28.70 g ZnSO4•7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4•H2O的质量,进而确定温度;
(4)①由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;
②草酸的酸性比碳酸强,草酸与碳酸钠的物质的量按2:1充分混合后,生成草酸氢钠、水和二氧化碳,溶液中pH<7,溶液显酸性,说明草酸氢根离子的电离程度大于水解程度,据此分析;
(5)据其Ksp计算.
解答 解:(1)肼-氧气碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,正极发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(2)根据题中信息,铂溶于王水时产生[PtCl6]2-和一种无色气体为一氧化氮,反应的离子方程式为:3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O,
故答案为:3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)28.70 g ZnSO4•7H2O的物质的量为0.1mol,若得ZnSO4•H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b;
(4)①由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;故答案为:<;
②草酸的酸性比碳酸强,草酸与碳酸钠的物质的量按2:1充分混合后,生成草酸氢钠、水和二氧化碳,溶液中pH<7,溶液显酸性,说明草酸氢根离子的电离程度大于水解程度,草酸氢根离子的电离和水解程度都很小,Na+不水解,浓度最大,其次是草酸氢根离子.氢离子有两个来源,草酸氢根离子的电离和水的电离,所以该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)Ksp=1.0×10-38=c(Fe3+)×c3(OH-),c(Fe3+)=1.0×10-2mol•L-1,故c (OH-)=1.0×10-12 mol•L-1,又KW=1.0×10-14,故c (H+)=1.0×10-2 mol•L-1,pH=2,故将Fe3+转换为Fe(OH)3沉调节溶液pH至少大于2,故答案为:2.
点评 本题主要考查的是电极反应式书写、离子方程式书写、离子浓度大小比较以及溶度积常数的计算等,难度较大.


科目:高中化学 来源: 题型:选择题
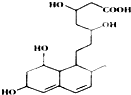
| A. | 含有两种官能团 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液可以清洗油污的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 在强碱溶液中NaClO与Fe(OH)3反应制备Na2FeO4:3ClO-+2Fe(OH)3+4OH?=2FeO42-+3Cl-+5H2O | |
| C. | 铜制品表面的水膜酸性较强时,发生电化学腐蚀,正极反应为2H++2e-=H2↑ | |
| D. | 向AgNO3溶液中加过量NaCl后再加Na2S溶液,白色沉淀变黑色 2Ag++S2-=Ag2S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
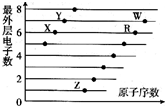
| A. | ZY、ZW的水溶液都显酸性 | |
| B. | 原子半径大小:W>R>X,离子半径大小:Z+>R2->W->Y- | |
| C. | W的氢化物水溶液的酸性比R的氢化物水溶液的酸性强,可证明非金属性:W>R | |
| D. | Z、X两种元素形成的Z2X、Z2X2为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
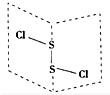 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )| A. | S2Cl2的电子式为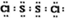 | |
| B. | 反应中SO2是还原产物,S是氧化产物 | |
| C. | S2Cl2为含有极性键和非极性键的极性分子 | |
| D. | 反应中,生成1molSO2,转移电子为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
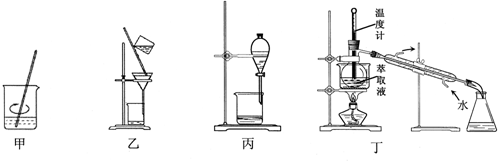
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com