
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
科目:高中化学 来源:不详 题型:单选题

| A.滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(CH3COOH)>c (H+)> c(OH-) |
| B.点①所示溶液中酸的中和率大于50% |
| C.点②是二者恰好中和点 |
| D.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10电子的离子对H2O的电离平衡均能产生影响 |
B.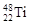 与 与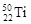 两种核素均是周期表第四周期主族元素 两种核素均是周期表第四周期主族元素 |
| C.IA族元素的原子半径比ⅦA族元素的原子半径大 |
| D.原子序数相差8的两种短周期元素,其周期序数相差1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该温度下醋酸的电离平衡常数约为1×10-5mol·L-1 |
| B.图中V1 > 20mL,且a点对应的溶液中: c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-) |
| C.图中V1 < 20mL,且a点对应的溶液中: c (CH3COOH) + c (CH3COO-)<c (Na+) |
| D.当加入Na OH溶液的体积为20mL时,溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HNO2 | B.HCOOH | C.HCN | D.H2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 液面处的读数是a,则滴定管中剩余液体的体积是______mL
液面处的读数是a,则滴定管中剩余液体的体积是______mL 各待盛溶液润洗。
各待盛溶液润洗。| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
 ① ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com