
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
分析 A.金属单质中元素的化合价为最低价;
B.Mg、Al易形成致密的氧化膜;
C.铝与氧气反应生成氧化铝的熔点高;
D.Fe在氧气中能够燃烧.
解答 解:A.金属单质中元素的化合价为最低价,最低价只有还原性,所以金属单质都有还原性,故A正确;
B.Mg、Al易形成致密的氧化膜,致密的氧化膜能阻止氧气与内部金属反应,所以Mg、Al能直接置于空气中保存,故B正确;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,Al2O3熔点一定高于Al单质,故C正确;
D.钠和镁可以剧烈地燃烧,Fe在氧气中能够燃烧生成四氧化三铁,故D错误.
故选D.
点评 本题考查了金属单质的化学性质,题目难度不大,侧重于基础知识的考查,注意把握Na、Mg、Al、Fe等金属的性质.


科目:高中化学 来源: 题型:解答题
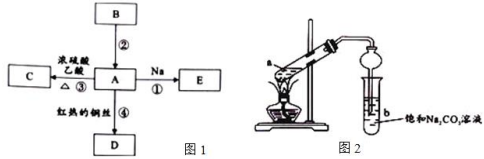
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
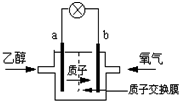
| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

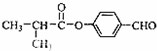 ;
;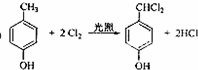 ;
;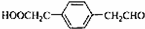 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com