
设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应
FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应
②Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H=Q2的平衡常数为K2,在不同温度下,
FeO(s)+H2(g) △H=Q2的平衡常数为K2,在不同温度下,
K1、K2的值如下:
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=Q3
CO(g)+H2O(g) △H=Q3
①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________________。
A.缩小容器体积 B.降低温度
C.使用合适的催化剂 D.设法减少CO的量
E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
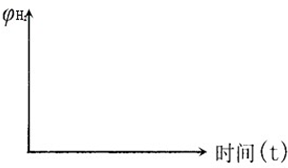
(3)现在恒容密闭容器中通入一定量CO2,再慢慢通入H2,使发生上述反应③,在其他条件不变时,若改变H2的起始量,容器中 CO的体积分数也随之改变,请在下图中画出CO的体积分数随n(H2)变化的示意图。

科目:高中化学 来源: 题型:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| K1 |
| K2 |
| K1 |
| K2 |
| 各物质某一状态时的物质的量浓度/mol?L-1 | ||||||
| c(CO2) | c(H2 ) | c(CO) | c(H2O ) | Qc | 平衡 | |
| ① | 0.004 | 0.004 | 0.006 | 0.006 | 已达平衡 | |
| ② | 0.062 | 0.084 | 0.039 | 0.279 | 2.09 | |
| ③ | 0.182 | 0.086 | 0.098 | 0.359 | 2.25 | |
| ④ | 0.078 | 0.142 | 0.280 | 0.120 | 平衡逆向移动 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| c(H2)?c(CO2) |
| K1 |
| K2 |
| K1 |
| K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 FeO(s)+CO(g) 平衡常数为K1;
FeO(s)+CO(g) 平衡常数为K1; FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com