
 ;
; .
. 分析 (1)质子数为8的原子为氧原子,利用质量数=质子数+中子数来分析;
(2)金属强的元素在元素周期表中的左下方的位置;
(3)短周期中内层电子数是最外层电子数2倍的原子有锂;
(4)硫离子的核电荷数为16,核外电子总数为18,最外层含有8个电子,据此画出硫离子的离子结构示意图;
(5)短周期中酸性最强的含氧酸是高氯酸;
(6)二氧化碳是共价化合物,C原子最外层4个电子,O原子最外层6个电子.
解答 解:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)金属强的元素在元素周期表中的左下方的位置,金属性最强是钠,故答案为:Na;
(3)短周期中内层电子数是最外层电子数2倍的原子有锂,故答案为:锂;
(4)硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,
,
故答案为: ;
;
(5)短周期中酸性最强的含氧酸是高氯酸,故答案为:HClO4;
(6)二氧化碳是共价化合物,C原子最外层4个电子,O原子最外层6个电子,所以二氧化碳的电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查了离子结构示意图的书写,题目难度不大,明确粒子结构示意图的表示方法为解答关键,试题侧重 基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
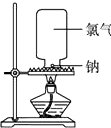 下面是钠和氯气反应的实验设计:
下面是钠和氯气反应的实验设计:| 现象 | |
| 化学方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=3的盐酸和PH=11的氨水 | B. | PH=3的硝酸和PH=11的Ba(OH)2溶液 | ||
| C. | PH=3的硫酸和PH=11的氨水 | D. | PH=3的醋酸和PH=11的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
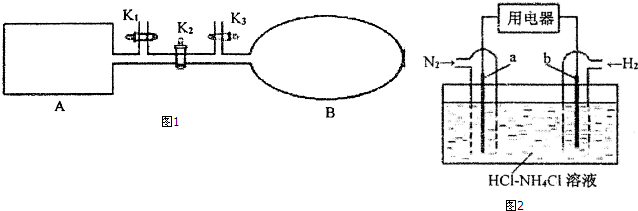
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=$\frac{1}{2}$Q | B. | Q1<$\frac{1}{2}$Q | C. | Q1>$\frac{1}{2}$Q | D. | Q1=Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com