
在某无色透明的酸性溶液中,能大量共存的离子组是
| A.Na+ 、K+、SO42-、HCO3- | B.Na十、Ba2+、NO3-、SO42- |
| C.Na+、 K+、Cl-、 NO3- | D.Fe3+、K+、SO42-、OH- |
C
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。溶液显酸性,A中HCO3-不能大量共存。B中Ba2+和SO42-不能大量共存;D中Fe3+和OH-不能大量共存,且铁离子在溶液中显棕黄色,答案选C。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。


科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mo1/L NaI溶液:K+、Na+、MnO4-、OH- |
| B.能溶解CaCO3的溶液:K+、NH4+、Cl-、NO3- |
| C.0.1mo1/LNaHSO3溶液:Na +、Mg2+、SO42-、ClO- |
| D.c(H+)/c(OH-)=1013,的溶液:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子能在水溶液中大量共存的一组是
| A.Fe3+、HCO3ˉ、Clˉ、SCNˉ | B.Ba2+、NO3ˉ、SO32ˉ、H+ |
| C.Mg2+、NH4+、Brˉ、OHˉ | D.Na+、Cu2+、SO42ˉ、Clˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验现象及相关的离子方程式均正确的是( )
| A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体 CaCO3 + 2H+=Ca2+ + CO2↑ + H2O |
| B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色 2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O |
| D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C.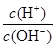 =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,下列各组离子、分子在指定溶液中一定能大量共存的是
| A.Na2S溶液中 SO42-、 K+、Br-、Cu2+ |
| B.在c(H+)=1.0×10-13mol·L-1的溶液中 Na+、S2-、AlO2-、SO32- |
| C.能使甲基橙显红色的溶液: K+、MnO4-、H2C2O4、SO42- |
| D.在 NH3·H2O 的溶液中Ba2+、NO3-、Cl-、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式表达正确的是
| A.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| B.向Fe(OH)2中加入足量的稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
| C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3·H2O |
| D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下: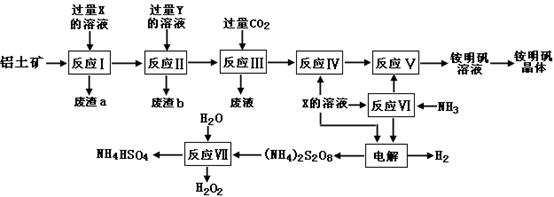
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。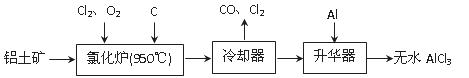
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com