

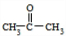 .
.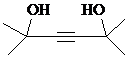 .
.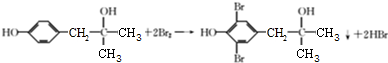 .
.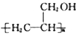 的合成路线图(无机试剂任用).合成路线图示例如下:
的合成路线图(无机试剂任用).合成路线图示例如下:分析 (1)由X的结构简式可知,含有的含氧官能团为酯基、羟基;A的分子式为C3H6O,A的核磁共振氢谱只有一组吸收峰,结合B的结构简式可知与乙炔发生加成反应生成B,故A为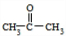 ;
;
(2)反应①还会得到另一产物H,其分子式为C8H14O2,则2分子丙酮与乙炔发生加成反应生成H;
(3)F与过氧乙酸反应得到G,由守恒可知还生成乙酸;
(4)X分子消去一分子水可得物质J,J的分子式为C10H14O2,不饱和度为$\frac{2×10+2-14}{2}$=4,J的同分异构体符合:
a.能与FeCl3溶液发生显色反应,说明含有酚羟基,由不饱和度可知,侧链没有不饱和键,
b.能发生消去反应,说明羟基连接碳原子相邻的碳原子上含有H原子,
c.苯环上只有2个取代基,且分子中只有2个甲基,另外的取代基为-CH(CH3)CH(CH3)OH,或者为-C(OH)(CH3)CH2CH3,或者为-CH2C(CH3)2OH,或者为-CH(OH)CH(CH3)2,与羟基各有邻、间、对3种;
(5)甲醇氧化生成甲醛,甲醛与乙炔发生加成反应得到HC≡CCH2OH,再与氢气发生加成反应得到CH2=CHCH2OH,最后发生加聚反应得到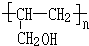 .
.
解答 解:(1)由X的结构简式可知,含有的含氧官能团为酯基、羟基;A的分子式为C3H6O,A的核磁共振氢谱只有一组吸收峰,结合B的结构简式可知与乙炔发生加成反应生成B,故A为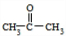 ,
,
故答案为:醛基、羟基;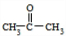 ;
;
(2)反应属于加成反应,反应①还会得到另一产物H,其分子式为C8H14O2,2分子丙酮与乙炔发生加成反应生成H,H的结构简式为: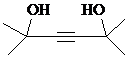
故答案为:加成反应;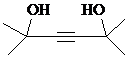
(3)F与过氧乙酸反应得到G,由守恒可知还生成CH3COOH,
故答案为:CH3COOH;
(4)X分子消去一分子水可得物质J,J的分子式为C10H14O2,不饱和度为$\frac{2×10+2-14}{2}$=4,J的同分异构体符合:
a.能与FeCl3溶液发生显色反应,说明含有酚羟基,由不饱和度可知,侧链没有不饱和键,
b.能发生消去反应,说明羟基连接碳原子相邻的碳原子上含有H原子,
c.苯环上只有2个取代基,且分子中只有2个甲基,另外的取代基为-CH(CH3)CH(CH3)OH,或者为-C(OH)(CH3)CH2CH3,或者为-CH2C(CH3)2OH,或者为-CH(OH)CH(CH3)2,与羟基各有邻、间、对3种,共有12种,其中核磁共振氢谱只有六组吸收峰的同分异构体与足量浓溴水反应的化学方程式为: ,
,
故答案为:12; ;
;
(5)甲醇氧化生成甲醛,甲醛与乙炔发生加成反应得到HC≡CCH2OH,再与氢气发生加成反应得到CH2=CHCH2OH,最后发生加聚反应得到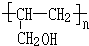 .合成路线流程图为:
.合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的合成、官能团、有机反应类型、限制条件同分异构体书写等,(4)中同分异构体的书写为易错点、难点,是对有机化学的综合考查.


科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
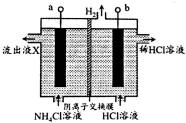 NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )
NCl3是一种黄色粘稠的油状液体(已知电负性:N>Cl)装置如图所示,利用惰性电极电解制备,原理是:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,下列说法错误的是( )| A. | b电极接电源的负极 | |
| B. | 阳极区被氧化的元素为Cl | |
| C. | 流出液X中不含HCl | |
| D. | 每生成3molH2,有6molCl-通过阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
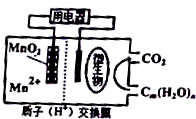
| A. | 在高温下使用更利于微生物发挥作用 | |
| B. | 每生成1molCO2转移4mole- | |
| C. | 放电过程中,质子通过交换膜从左侧移到右侧 | |
| D. | 负极反应式为:Mn2++2H2O-2e-=MnO2+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
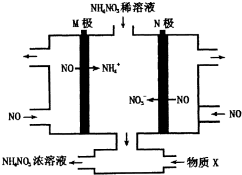
| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
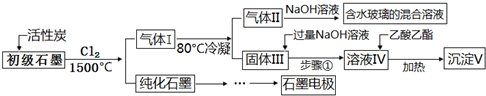
| A. | 向反应器中通入Cl2前,需通一段时间N2,主要目的是排除空气,减少碳的损失 | |
| B. | 在1500℃高温条件下,反应后初级石墨中的氧化物杂质均转变为相应的氯化物和CO2 | |
| C. | 步骤①为:搅拌、过滤,所得溶液IV中的阴离子有Cl-、OH-、AlO2? | |
| D. | 100 g初级石墨最多可获得V的质量为7.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鼓励使用太阳能、风能等淸洁能源能减少PM2.5的污染 | |
| B. | 用含有橙色酸性K2Cr207的仪器检验酒驾,利用了乙醇的挥发性和氧化性 | |
| C. | 粮食酿酒的制造原理为淀粉水解变成葡萄糖,葡萄糖再水解得到酒精 | |
| D. | 与铜质水龙头连接处的钢质水管易发生析氢腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com