
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。

①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
【答案】SO2 OH-+SO2==HSO3- NH3·H2O+ SO2==HSO3-+NH4+ NO CO2 8mol 4:3 ClO-+SO2+H2O==SO42-+Cl-+2H+ I2 SO2+I2+2H2O== H2SO4+2HI 2HI==H2+I2
【解析】
本题主要考查常见化学反应方程式的书写以及相关性质判断及计算。
(1)酸性氧化物是指能与水作用生成酸或与碱作用生成盐和水的氧化物(且生成物只能有一种盐和水,不可以有任何其它物质生成);
(2)①②根据题干信息进行书写即可;
(3)①该反应中CO中C的化合价升高2价,NO中N的化合价降低2价;②根据电子得失计算;
(4)由题干信息中“生成的产物都无毒”可知,生成物为N2和H2O,根据氧化还原反应中化合价升降相等或化学方程式计算;
(5)由题干信息计算出化合价升高总数或失电子总数,根据氧化还原反应中得失电子数相等判断ClO-与SO2的系数比,再根据该反应的化学环境为酸性配平化学方程式;
(5)①根据反应II中元素守恒以及化合价升降判断X;
②反应I为X与SO2和H2O反应生成HI和H2SO4,根据氧化还原反应配平原则配平;
③反应II为HI分解为X和H2。
(1)上述气体中,属于酸性氧化物的是SO2;
(2)①根据题干信息可知,NaOH与过量SO2反应生成NaHSO3,故其离子反应方程式为:OH-+SO2==HSO3-;
②由题干信息可知,氨水吸收过量的SO2,生成NH4HSO3,其离子反应方程式为:NH3·H2O+ SO2==HSO3-+NH4+;
(3)①该反应中CO中C元素的化合价升高2,NO中N元素的化合价降低2,故氧化剂是NO;氧化产物为CO2;
②由该反应化合价升降可知,每生成1molN2,转移电子4mol,故当生成2mol N2时,转移电子的物质的量是8mol;
(4)该反应的化学方程式为:8NH3+6NO2![]() 7N2+6H2O,该反应中氧化剂为NO2,还原剂为NH3,根据方程式可知,还原剂与氧化剂之比为4:3;
7N2+6H2O,该反应中氧化剂为NO2,还原剂为NH3,根据方程式可知,还原剂与氧化剂之比为4:3;
(5)该反应过程中,0.01molSO2被氧化失去电子0.02mol,0.01molNaClO被还原,根据得失电子数相等可知,还原产物为Cl-,故该离子方程式为:ClO-+SO2+H2O==SO42-+Cl-+2H+;
(6)①反应II为HI的分解反应:2HI===H2![]() +I2,故X为I2;
+I2,故X为I2;
②由上述分析可知,反应I为I2与SO2和H2O反应生成HI和H2SO4,其化学方程式为SO2+I2+2H2O== H2SO4+2HI;
③反应II的化学方程式为2HI===H2![]() +I2。
+I2。


科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g) ![]() 4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=0.9 mol·L-1·min-1 B. v(B)=1.5 mol·L-1·min-1
C. v(D)=0.8 mol·L-1·min-1 D. v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(2018·天津市南开中学第五次月考)Ⅰ.对有机物X 的组成结构、性质进行观察、分析,得到实验结果如下:
①X为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166 mg有机物X,得到352 mg CO2和54mg H2O;
③X分子中只有2 种不同结构位置的氢原子;
④X的相对分子质量在100~200之间。
根据以上信息回答下列问题:
(1)X的分子式为_____________,结构简式为_________________________。
(2)X的一种同分异构体(与X具有相同的官能团),在一定条件下可发生分子内脱水反应生成一种含有五元环的有机物Y,Y的结构简式为______________________。
(3)X的某些同分异构体具有如下性质:
a.能发生水解反应 b.能发生银镜反应 c.能使氯化铁溶液显紫色。
请写出可能的结构简式_______________________________(任写两种)。
Ⅱ.工业上以丁二烯(CH2=CH-CH=CH2)为原料合成丁烯二酸(HOOC-CH=CH-COOH)的合成路线如图所示:

请回答下列问题:
(4)写出反应类型:①_______________,②_______________。
(5)写出反应②⑤的化学方程式(注明反应条件):
②______________________________________;
⑤_______________________________________。
(6)在上述合成路线中,有同学提议略去③④⑤⑥反应,由HOCH2CH=CHCH2OH直接氧化制得丁烯二酸而使合成步骤简化,请你评价该建议是否合理? 并写出你的理由。______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
A.容器内气体密度不随时间变化
B.v (X): v (Y)= l:2
C.容器内X、Y、Z的浓度不随时间变化
D.单位时间消耗0.1 molX同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl 广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O 制备CuCl,并进行相关探究。
【资料查阅】得知:CuCl常温下是固体,露置于空气中易被氧化为绿色的高价铜盐。CuCl2·2H2O加热分解的情况如右图所示:
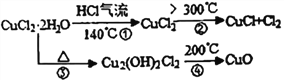
【实验探究】该小组用如图所示装置进行实验(夹持仪器已略)。

根据以上信息请回答下列问题:
(1)装置E的作用是____________________。
(2)实验操作的先后顺序是a→______________________(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)某同学设计的检验该装置气密性的方法是:将装置E上面的倒置漏斗换成导管,在烧杯中加少量水,将导管插入水中,在装置的气体入口处装上橡皮管,并用弹簧夹夹紧,用酒精灯微微加热玻璃管,若导管口有气泡冒出,撤去热源后,导管中有一段稳定的水柱,则装置气密性良好。你认为该同学的设计是否合理________(填“是”或“否”)。
(4)在实验过程中观察到C中纸条的颜色不变,D中纸条的先变红后褪色,其褪色的原因可能是________(填序号)。
A.氯化氢水溶液有漂白性 B.氯气的水溶液有漂白性
C.氯化氢气体有漂白性 D.干燥的氯气有漂白性
(5)停止通入HCl后,通入N2的目的是____________________。
(6)上述CuCl2·2H2O加热分解过程中④中发生反应的化学反应方程式是________________________。
(7)配平工业制备CuCl时发生反应的离子方程式:
Cu2++Cl-+SO32-+H2O→CuCl+H++SO42-,请依次写出配平后的化学计量数__________。
(8)准确称取所制备的氯化亚铜药品mg,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。若滴定结束时,滴定管中有气泡,则样品中CuCl 的质量分数_________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命。在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO。下列有关“84”消毒液的说法正确的是
A. “84”的消毒液属于纯净物
B. “84”的消毒液除能杀菌消毒外,还可作漂白剂
C. “84”消毒液中的NaClO比较稳定,不需密封保存
D. “84”消毒液杀菌消毒过程中并未发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,经搅拌、静置、过滤。取滤液,用铂电极电解该滤液一段时间。则两个极区析出的氧化产物与还原产物的质量比约为( )
A.35.5∶108 B.108∶35.5
C.8∶1 D.1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com