
��12�֣���1��ij�о���ѧϰС����ʵ����������1 mol/L��ϡ�������Һ��Ȼ������ζ�ijδ֪Ũ�ȵ�NaOH��Һ�������й�˵������ȷ����______________��
A��ʵ�������õ��ĵζ��ܡ�����ƿ����ʹ��ǰ����Ҫ��©��
B�����ʵ��������60 mL ϡ�������Һ������ʱӦѡ��100 mL����ƿ��
C������ƿ�к�����������ˮ���ᵼ���������Һ��Ũ��ƫС��
D����ʽ�ζ���������ˮϴ�Ӻ�װ���Ũ�ȵ�ϡ���ᣬ���õ�NaOH��Һ��Ũ�Ƚ�ƫ��
E���к͵ζ�ʱ���������һ�ζ���ʱ���Ӷ������������ʵ����ƫ��
��2�������£���֪0.1 mol��L��1һԪ��HA��Һ��c(OH��)/c(H+)��1��10��8��
�ٳ����£�0.1 mol��L��1 HA��Һ��pH= ��д�����ᣨHA����NaOH��Һ��Ӧ�����ӷ���ʽ�� ��
��pH��3��HA��pH��11��NaOH��Һ�������Ϻ���Һ��4���������ʵ���Ũ�ȴ�С��ϵ�ǣ� ��
��0.2 mol��L��1HA��Һ��0.1mol��L��1NaOH��Һ�������Ϻ�������Һ�У�c(H+)��c(HA)��c(OH��)�� mol��L��1������Һ����仯���Բ��ƣ�
��3��t��ʱ����pH=2��ϡ�����pH=11��NaOH��Һ�������Ϻ���Һ�����ԣ�����¶���ˮ�����ӻ�����Kw= �����¶��£�t�棩����100 mL 0.1 mol��L-1��ϡH2SO4��Һ��100 mL 0.4 mol��L-1��NaOH��Һ��Ϻ���Һ����仯���Բ��ƣ�����Һ��pH= ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���ʮУ���������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ˮϵ﮵�ؾ��а�ȫ�������ͼ۸�������ŵ��Ϊ��ǰ����о�������ȵ㡣�Է����ƣ�NaV3O8��Ϊ�������ϵĵ缫��ӦʽΪ��NaV3O8+xLi++xe��= NaLixV3O8��������˵������ȷ����

A���ŵ�ʱ�������ĵ缫��Ӧʽ��Li��e�� Li+
Li+
B����������Li��������������Ǩ��
C���������������ĵ缫��ӦʽΪNaLixV3O8��xe��=NaV3O8+xLi+��NaLixV3O8�з��Ļ��ϼ۷����仯
D���õ�ؿ�������������Һ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡԭƽ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����SO2�������Ƿ���CO2����Ӧ���õķ�����
A��ͨ��ʯ��ˮ B����ͨ������KMnO4��Һ��ͨ��ʯ��ˮ
C��ͨ��Ʒ����Һ D����ͨ��С�մ���Һ��ͨ��ʯ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡԭƽ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ�˸��õر�ʾ��Һ������ԣ���ѧ���������ȣ�AG���ĸ��AG==lgc(H+)/c(OH��)����֪������ij��ɫ��Һ��AG==12�������Һ�д����������������
A��Na+ ��AlO2�� ��K+ ��NO3��
B��MnO4����K+ ��SO42�� �� Na+
C��Mg2+ �� SO42���� HCO3�� ��Na+
D��NH4+ ��NO3���� Al3+ ��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡԭƽ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��2A��B 2C��D��Ӧ�У���ʾ�÷�Ӧ����������
2C��D��Ӧ�У���ʾ�÷�Ӧ����������
A��v��A��=0.8mol��L��1��s��1 B��v(B)=0.3mol��L��1��s��1
C��v(C)=0.6mol��L��1��s��1 D��v(D)=0.5mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ��������������У�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�и�����Ũ�ȹ�ϵ����ȷ����
A��0.1mol��L��1 HCOOH��Һ�У�c(HCOO-)��c(OH��)��c(H��)
B��0.1mol��L��1 NH4Cl��Һ�У�c(NH4+)+c(NH3H2O)��c(Cl-)
C��0.1mol��L-1NaHCO3��Һ�У� c(Na+)+c(H+)+c(H2CO3)��c(HCO3-)+c(CO32-)+c(OH-)
D��������������ʵ���Ũ�ȵ�CH3COONa������CH3COOH��Ϻ����Һ�У�c(CH3COO-) �Cc(CH3COOH)= 2c(H+)- 2c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ��������������У�߶���ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ���ձ���ʢ�к�ˮ���������б���ʴ�ɿ쵽����˳��Ϊ

A���ڢ٢ۢܢݢ� B���ݢܢۢ٢ڢ�
C���ݢܢڢ٢ۢ� D���ݢۢڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ��������������У��һ��ѧ����ĩ������ѧ�Ծ��������棩 ���ͣ������
��7�֣���20 mL AlCl3��Һ�е���2 mol/L NaOH��Һʱ���õ����������������μ�NaOH��Һ���������ͼ��ϵ��

��1��ͼ��A���ʾ�������� ��
��2��ͼ��B���ʾ�������� ��
��3������Һ����Al(OH)3����0.39 g������ȥNaOH��Һ���������Ϊ �� ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶Ⱥ�ѹǿ�����·����˷�Ӧ��CO2(g)+3H2 (g)  CH3OH(g)+H2O(g) ��H��0,��Ӧ�ﵽƽ��ʱ���ı��¶ȣ�T����ѹǿ��p������Ӧ�����CH3OH�����ʵ����������仯�����ͼ��ʾ�������¶ȣ�T����ѹǿ��p���Ĺ�ϵ�ж���ȷ����
CH3OH(g)+H2O(g) ��H��0,��Ӧ�ﵽƽ��ʱ���ı��¶ȣ�T����ѹǿ��p������Ӧ�����CH3OH�����ʵ����������仯�����ͼ��ʾ�������¶ȣ�T����ѹǿ��p���Ĺ�ϵ�ж���ȷ����
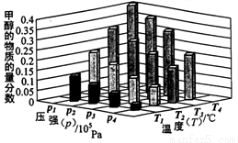
A��P3��P2 T3��T2
B��P2��P4 T4��T2
C��P1��P3 T3��T1
D��P1��P4 T2��T3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com