
 香叶醇是合成玫瑰精油的主要原料,其结构简式如下:
香叶醇是合成玫瑰精油的主要原料,其结构简式如下:分析 (1)根据有机物的结构简式确定分子式,交点、端点为碳原子,用H原子饱和碳的四价结构;
(2)含有-CH2OH、碳碳双键,具有烯烃、醇的性质;
(3)碳碳双键能与氢气发生加成反应;
(4)香叶醇与足量的氢气发生加成反应后得到的产物为饱和一元醇,与乙醇互为同系物;
(5)1molCxHyOz的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol.
解答 解:(1)根据有机物的结构简式,可知其分子式为C10H18O,故答案为:C10H18O;
(2)含有-CH2OH、碳碳双键,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故答案为:能;
(3)碳碳双键能与氢气发生加成反应,1mol香叶醇与氢气发生加成反应最多消耗2mol氢气,故答案为:2;
(4)香叶醇与足量的氢气发生加成反应后得到的产物为饱和一元醇,与乙醇互为同系物,故答案为:可以;
(5)香叶醇的分子式为C10H18O,1mol香叶醇消耗氧气为(10+$\frac{18}{4}$-$\frac{1}{2}$)mol=14mol O2,故答案为:14.
点评 本题考查有机物的结构与性质,注意掌握有机物的官能团与性质的关系,熟悉烯烃、醇的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A.天然气燃烧 | B.自然界中丁达尔效应 | C.蛋白质受热凝固 | D.食醋除水垢 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫与氢氧化钠溶液反应 | B. | 钠与氧气的反应 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.观察Fe(OH)2 的生成 | B.中和滴定 | C.除去CO2气体中 的HCl气体 | D.制取并收集干燥 的氨气 |
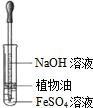 |  | 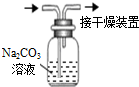 | 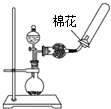 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
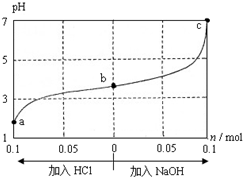 25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )
25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | a、b、c三点都有c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O7 | D. | Fe7O10 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
下列操作正确的是
A. pH试纸直接蘸取NaOH溶液测定其pH
B. 存放化学品的仓库失火后,尽快用水灭火
C. 蒸馏时,加热一段时间后,再投入沸石
D. 切割剩下的白磷放回原试剂瓶水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com