
| A.降温 | B.加压 |
| C.使用催化剂 | D.加大反应物浓度 |
科目:高中化学 来源:不详 题型:单选题
| A.a%>b% | B.a%<b% | C.a%="b%" | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 30℃ | 块 状 |
| B | 0.5mol?L-1 | 30℃ | 粉末状 |
| C | 1mol?L-1 | 35℃ | 块 状 |
| D | 1mol?L-1 | 35℃ | 粉末状 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.使用催化剂不改变反应速率 |
| B.改变温度对反应速率无影响 |
| C.升高温度能加快反应速率 |
| D.使用催化剂能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
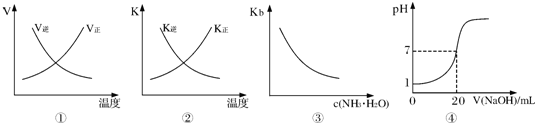
| A.图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化 |
| B.图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化 |
| C.图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化 |
| D.图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验序号 | H2O2溶液浓度 | H2O2溶液温度 | 催化剂 | 所用时间 |
| ① | 5% | 20℃ | 2滴1mol/LFeCl3 | t1 |
| ② | 5% | 40℃ | 2滴1mol/LFeCl3 | t2 |
| ③ | 10% | 20℃ | 2滴1mol/LFeCl3 | t3 |
| ④ | 5% | 20℃ | 不使用 | t4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3溶液 | |
| ③ | ______ | ______ | ______ | |
| ④ | ______ | ______ | ______ |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol/(L?min)) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.全部 | B.(2)(3) | C.(4) | D.(2)(3)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com